Тромболизис что это такое последствия
ТРОМБОЛИЗИС ПРИ ИНФАРКТЕ МИОКАРДА
УДК 616.127-005.8:616.151.5-08
Р.Б.Абдрасулов, К.Т.Мусаханов, Р.К.Идрисов, М.Е.Байбориева, И.К.Авамов
Кафедра анестезиологии и реаниматологии с курсом скорой неотложной помощи
ИПО КазНМУ имени С.Д. Асфендиярова
Своевременное применение тромболитической терапии при лечении инфаркта миокарда улучшает прогноз заболевания. Сохраняется объем жизнеспособного миокарда и уменьшается степень постинфарктного склерозирования мышечной ткани. Актилизе обладает большей фибринолитической активностью при остром и повторном инфаркте миокарда.
Ключевые слова: кардиология, острый коронарный синдром, инфаркт миокарда, ишемический инсульт, тромбоз, гемоделюция.
В лечении инфаркта миокарда можно выделить несколько основных направлений:
— купирование болевого приступа;
— восстановление коронарного кровотока;
— предупреждение опасных для жизни аритмий;
Оптимальное решение этих задач достигается при наличии организационных звеньев: специализированной кардиологической бригады скорой помощи, отделения реанимации и интенсивной терапии и кардиологического отделения
Максимально быстро поставленный диагноз инфаркта миокарда или хотя бы острого коронарного синдрома диктует два варианта лечебной тактики: у больных со стойким подъемом сегмента STнеобходимо всеми доступными методами (тромболизис, коронаро-ангиопластика, стентирование) восстановить коронарный кровоток, для остальных тромболизис неэффективен и лишь чреват осложнениями.
Восстановление артериальной проходимости, предотвращение дальнейшего тромбообразования, в том числе и микротромбов, нарушающих тканевой кровоток, — одна из основных задач в лечении острого инфаркта миокарда.
При этом, хотя процессы гиперкоагуляции могут носить распространенный характер, основное внимание уделяется, естественно, коронарному кровообращению.
Можно считать доказанной возможность спонтанного тромболизиса.
Однако для многих больных восстановление коронарного кровотока возможно лишь с помощью специальных мероприятий.
К тому же и спонтанный лизис обтурирующего коронарную артерию тромба может произойти в относительно поздние сроки.
В растворении фибринового тромба главную роль играет плазмин.
В плазме крови в значительном количестве содержится его неактивный предшественник плазминоген.
Эндотелий сосудов постоянно выделяет в сосудистое русло мощный фактор — тканевой активатор плазминогена, который в свою очередь нейтрализуется специфическим ингибитором активатора плазминогена.
Образующийся же в крови плазмин инактивируется другим специфическим ингибитором — а2-антиплазмином. Вся эта система находится в постоянном равновесии.
Если активность ингибиторов снижается и тем самым увеличивается образование плазмина в крови и замедляется его нейтрализация, плазмин может оказать фибринолитическое действие.
Спонтанный тромболизис с реканализацией коронарной артерии может произойти слишком поздно, когда гибель кардиомиоцитов уже неизбежна.
В то же время даже ранняя — спонтанная или индуцированная — реканализация необязательно сопровождается восстановлением кровотока и питания кардиомиоцитов.
Причиной этого могут стать отек кардиомиоцитов с застоем в капиллярах и нарушением микроциркуляции, а также «реперфузионное кровоизлияние» вследствие некроза элементов сосудистой стенки и просачивания крови.
В экспериментальных и клинических исследованиях показано, что в первые часы после возникновения инфаркта миокарда эффективная тромболитическая терапия существенно ограничивает размеры некроза миокарда, причем эффект тем больше, чем раньше начато лечение.
Тромболитическая терапия может осуществляться с помощью системного (внутривенное введение) и внутрикоронарного введения препаратов.
Создание высокой концентрации тромболитика непосредственно в коронарном русле должно повысить вероятность восстановления проходимости артерии и уменьшить число осложнений.
Однако применение обоих методов у сопоставимых групп больных показало, что частота успешного тромболизиса различается не столь разительно и зависит преимущественно от времени, прошедшего от появления болей до начала тромболитической терапии, и соблюдения методических требований относительно доз препаратов и контроля их эффективности.
Если же имеются условия для проведения внутри-коронарных вмешательств, то стремятся осуществить экстренную чрескожную коронароангиопластику.
Следует отметить, что снижение летальности происходит в группах больных с подъемом сегмента STили со свежей блокадой ножки пучка Гиса, там же, где инфаркт миокарда протекает с депрессией сегмента ST, эффективность тромболитиков не доказана (сюда не входят больные, у которых в первые часы от начала приступа депрессия сегмента STсменилась его подъемом).
Вместе с тем вопрос о сроке от начала инфаркта миокарда, в течение которого можно получить эффект от тромболитической терапии, не до конца понятен.
В ряде случаев пациент не может точно указать время начала ангинозного приступа, тем более когда имеется серия приступов различной продолжительности.
Частота восстановления коронарного кровотока даже при проведении тромболизиса в течение 12—24 ч от начала инфаркта миокарда может достигать 50%.
Кроме того, даже позднее восстановление кровотока улучшает репарацию миокарда и предотвращает его постинфарктное ремоделирование.
По-видимому, необходимо изучение более отдаленных результатов «позднего» тромболизиса, однако уже сейчас представляется целесообразным введение тромболитика при рецидивирующих ангинозных приступах и сохраняющейся элевации ST>O,1— 0,2 mVне менее чем в двух отведениях, даже если болевой приступ начался за 12—24 ч до предполагаемого введения тромболитика.
При наличии некупирующейся симптоматики острой левожелудочковой недостаточности (кардиогенный шок и/или отек легких), сохраняющейся элевации STи невозможности провести экстренную баллонную ангиопластику также показано введение тромболитика через 12—24 ч от начала ангинозного приступа, поскольку тромболизис в данном случае является единственной реальной попыткой улучшить прогноз и предотвратить летальный исход.
Цель исследования: Оценить эффективность тромболитической терапии при инфаркте миокарда
Материал и методы: В настоящее время в нашей больнице используются активаторы плазминогена — препараты нативной стрептокиназы и тканевой активатор плазминогена алтеплаза ( актилизе),
Показаниями к применению тромболитиков у больных ишемической болезнью сердца являются развивающийся инфаркт миокарда с подъемом сегмента STсвыше 0,1 mV не менее чем в двух отведениях, а также со свежей блокадой левой ножки пучка Гиса и с давностью от начала приступа не более 12 ч, затяжное и рецидивирующее течение инфаркта миокарда, тромбоэмболические осложнения в большом и малом круге кровообращения.
Обсуждалась целесообразность введения тромболитиков и в более поздние сроки для улучшения состояния или даже спасения относительно долго сохраняющейся перинекротической зоны ишемизированного миокарда.
Выделяют абсолютные и относительные противопоказания к тромболитической терапии.
В рекомендациях Американской коллегии кардиологов и Американской ассоциации сердца приводятся следующие абсолютные противопоказания к тромболизису: геморрагический инсульт любой давности; другие нарушения мозгового кровообращения (включая транзиторные ишемические атаки) в течение последнего года; внутричерепные опухоли; внутреннее кровотечение (за исключением месячных); подозрение на диссекцию аорты.
Относительные противопоказания (необходима особая осторожность):
АД свыше 180/110 мм рт. ст. к моменту предполагаемого начала тромболизиса;
цереброваскулярные расстройства или внутричерепная патология, не отнесенные к абсолютным противопоказаниям;
проводимое лечение антикоагулянтами при международном нормализованном отношении > 2—3;
геморрагические диатезы, травмы в последние 2—4 нед., включая травматичную или длительную (более 10 мин) сердечно-легочную реанимацию;
большие хирургические вмешательства в последние 3 нед.; пункции сосудов, не поддающихся компрессии;
недавнее (2—4 нед.) внутренне кровотечение; беременность; открытая пептическая язва;
длительная тяжелая артериальная гипертензия в анамнезе.
Не рекомендуется вводить стрептокиназу при проводившемся с ее помощью тромболизисе в прошлом — особенно в сроки до двух лет, но, возможно, и в гораздо большие сроки; поскольку при первом введении произошла выработка антител и повторная инъекция может вызвать тяжелые аллергические реакции.
Существует несколько схем введения стрептокиназы в остром периоде инфаркта миокарда.
Схемы введения различаются по «агрессивности», при этом выбор той или иной схемы определяется в основном наличием или отсутствием симптоматики сердечной недостаточности, обусловленной систолической дисфункцией миокарда.
При отсутствии симптомов или их незначительной выраженности обычно применяется «стандартная» схема введения стрептокиназы: первая болюсная доза в 500 тыс. ME, вводимая в течение 3—5 минут, с последующей капельной инфузией 1 млн ME в течение 60 мин.
При наличии симптомов кардиогенного шока и/или отека легких возможно применение более агрессивных схем:
— болюсная доза 500 тыс. ME с последующей капельной инфузией 1 млн ME в течение 30 мин;
— болюсное введение 1 млн 500 тыс. ME в течение 10 мин;
— болюсное введение 1 млн 500 тыс. ME с последующей капельной инфузией 1 млн 500 тыс. ME в течение 30—60 мин;
— болюсное введение 3 млн ME в течение 10 мин.
Последние три схемы потенциально могут быть опасны повышенным риском кровотечений, в связи с чем должны применяться только у больных с кардиогенным шоком или резистентным к стандартной терапии отеком легких при невозможности выполнить экстренную коронарную баллонную ангиопластику.
Наш относительно небольшой опыт свидетельствует о том, что подобные схемы позволяют в ряде случаев предотвратить летальный исход у больных с кардиогенным шоком, при этом частота геморрагических осложнений не больше, чем при «стандартной» схеме введения.
Высокой тромболитической активностью обладает тканевой активатор плазминогена (т-АП), выпускаемый под названиями алтеплаза
Первоначально стандартная схема введения включала внутривенное введение 6—10 мг т-АП (болюс) с последующим капельным введением 50—54 мг (всего 60 мг за 1 ч) и дальнейшим введением 40 мг в течение 2 ч
Европейское общество кардиологов рекомендовало ускоренное введение т-АП: 15 мг болюсом, далее в дозе 0,75 мг/кг в течение 30 мин и затем 0,5 мг/кг в течение не менее 60 мин (при общей дозе также не более 100 мг).
При назначении т-АП рекомендуется внутривенное введение гепарина в течение 48 ч. Следует помнить, как указывал В.И. Метелица (1996), что натриевая соль гепарина не совместима с т-АП.
В связи с риском ретромбоза после окончания введения тромболитика рекомендуется внутривенная инфузия гепарина в дозе 700—1200 ЕД/ч под контролем активированного частичного тромбопластинового времени (АЧТВ), которое должно быть в 1,5—2 раза больше нормальных значений.
При стабильном клиническом состоянии больного через 2—3 суток переводят на подкожное введение 12 тыс.—30 тыс. ЕД гепарина в сутки (обычно в 4 приема) под контролем АЧТВ с последующим постепенным снижением дозы в течение 3— 5 дней с последующей отменой.
Кроме того, можно применять низкомолекулярные гепарины, в частности фраксипарин по 15 тыс. ЕД в два приема.
Эти препараты не менее эффективны, чем внутривенно вводимый стандартный гепарин, реже вызывают кровотечения и не требуют лабораторного контроля.
Признаками восстановления коронарного кровотока и маркерами эффективного тромболизиса являются: исчезновение или существенное ослабление болевого синдрома, стабилизация гемодинамики при кардиогенном шоке, учащение или появление более сложных форм желудочковой аритмии, а также ускоренного узлового ритма.
Существуют также и ЭКГ-методы оценки эффективности тромболитической терапии. Достаточно простым и достаточно достоверным является оценка динамики сегмента STна ЭКГ, которые регистрируются до и через 3 ч после начала введения тромболитика.
При этом оцениваются изменения STлибо в одном отведении с наибольшей элевацией, либо изменения суммарной элевации во всех отведениях, где она превышает 0,1 mV.
Если элевация STв одном отведении или суммарная элевация STуменьшается через 3 ч от начала введения тромболитика более чем на 50%, то это свидетельствует о восстановлении коронарного кровотока в инфарктсвязанной артерии.
Одновременно ускоряется вымывание из гибнущих клеток ферментов и миоглобина с быстрым увеличением их концентрации в крови.
При проведении тромболизиса необходимо как можно более раннее назначение дезагрегантов — аспирина 125—325 мг/сут. и/или клопигрель 300 мг которые в последующем должны применяться длительно (по крайней мере не менее 1 года).
Результат исследования: В нашей больнице тромболизис проводиться с 2009 года. Сначала тромболизис проводили препаратом стрептокиназы, после предварительного введения глюкокортикоидов (преднизолона-30-60мг, что увеличивало зону инфаркта) и блокаторов Н2-гистаминных рецепторов (квамател-20мг.). В данный момент используется алтеплаза ( актилизе).
2009г- 14 тромболизисов ( стрептокиназа 15фл)
2010г- 47 тромболизисов ( стрептокиназа 50фл, актилизе 2 фл)
2011г- 19 тромболизисов ( стрептокиназа 8фл, актилизе 14 фл)
2012г- 25 тромболизисов ( актилизе 42 фл)
2013г( с января по сентябрь влючительно) — 24 тромболизисов (актилизе 34 фл). С 2013 года после проведения тромболизиса больные направляются на ЧКВ.
Реперфузионные аритмии (практически никогда не приводящие к тяжелым последствиям) столь часты, что могут рассматриваться в качестве одного из маркеров реканализации коронарной артерии.), наблюдалось в 7 случаях.
Успешная реперфузия миокарда почти в 90% случаев сопровождается желудочковыми нарушениями ритма.
Чаще всего возникают поздние желудочковые экстрасистолы и ускоренный идиовентрикулярный ритм.
Сравнительно редким осложнением эффективной реперфузии является фибрилляция желудочков, 1 случай.
Обычно реперфузионные аритмии не ухудшают состояния больного кратковременно и не требуют применения антиаритмиков.
Для предупреждения реперфузионных аритмий может оказаться эффективным магния сульфат.
Обсуждение и выводы: Применение тромболитической терапии в лечении инфаркта миокарда улучшает прогноз заболевания. К положительным эффектам ТЛТ следует отнести и сохранение большего объема жизнеспособного миокарда и уменьшение степени постинфарктного ремоделирования. Эффективность актилизе выше, чем у стрептокиназы т.к. актилизе обладает прямой фибринолитической активностью и не вызывает сенсебилизации организма и может применяться при повторном инфаркте миокарда.
1 Алперт Д., Френсис Г. Лечение инфаркта миокарда. Практическое руководство. – М.: Практика. — 1994г. — 255 с.
2 Сыркин А.Н. Инфаркт миокарда. — 1991. – 304с.
3 Назаров И.П. Интенсивная терапия критических состояний: Учебное пособие / И.П.Назаров. – Ростов-на/Д: Феникс; 2007. – 608 с.
4 Сумин С.А. Неотложные состояния. 6-е издание. — 2006. – 799с.
5 Л.Т.Малая, Н.А.Власенко. Инфаркт миокарда. — 1981. – 488с.
6 И.Ю. Поздняков. Практическая кардиология. — М.: Бином-пресс, 2007. — 775 с.
Р.Б.Абдрасулов, К.Т.Мусаханов, Р.К.Идрисов,
М.Е.Байбориева, И.К.Авамов
С.Д Асфендияров атындағы ҚазҰМУ ДКИ кейінге қалдырылмайтын
жедел жәрдем курсымен анестизиология және реаниматология кафедрасы
Миокарда инфарктісі барысындағы тромболизис
Түйін: Қазіргі заман тромболитикалық терапиясын миокарда инфарктісінде қолдану барысында ауырудың жағдайы жақсарады. Өмірге қабілетті миокард көлемі сақталады және бұлшық ет тінінің постинфарктік склероз дәрежесі төмендейді. Актилиз қайталанған және қатты миокард инфарктісі барысында үлкен фибринолитикалық белсендікке ие болады.
R.B. Abdrasulov, K.T. Musakhanov, R.K. Idrisov,
M.E. Bayborieva, I.K. Avamov
Department of Anesthesiology and Reanimatology with the course of ambulance of
IPO KazNMU named after S.D Asfendiyarov
Thrombolysis in Myocardial Infarction
Resume: Early using of thrombolytic therapy in the treatment of myocardial infarction improves the prognosis. Stored volume of viable myocardium and decrease the degree of hardening of previous myocardial muscle tissue. Actilyse — has greater fibrinolytic activity in acute and recurrent myocardial infarction.
Что такое тромбоэмболия легочной артерии (ТЭЛА)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Гринберг М. В., кардиолога со стажем в 32 года.
Определение болезни. Причины заболевания
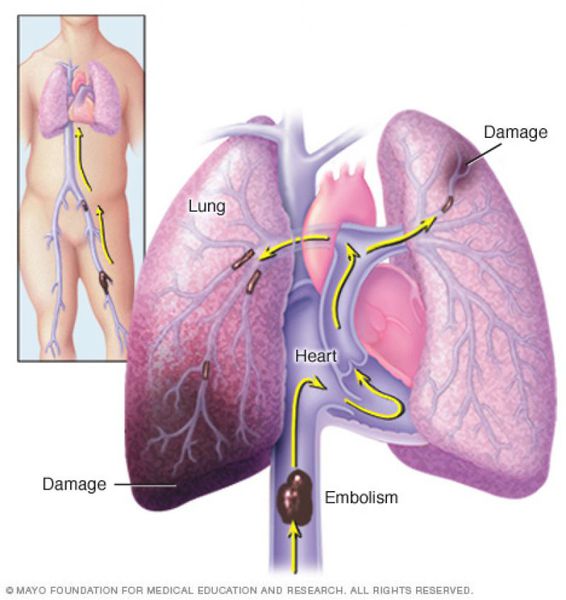
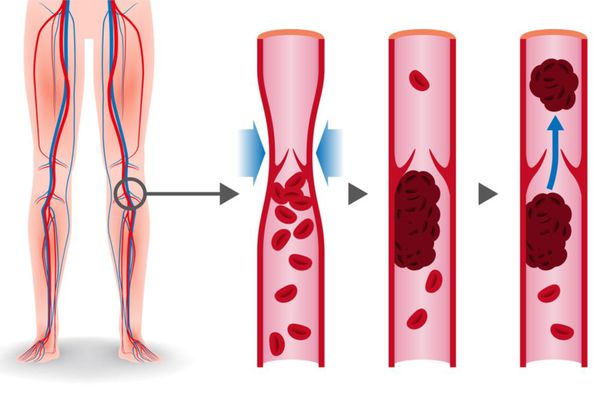
Тромбоэмболия лёгочной артерии (ТЭЛА) — это закупорка лёгочных артерий тромбами различной природы, чаще всего образующихся в крупных венах нижних конечностей или малого таза.
Факторами риска тромбоэмболии лёгочной артерии являются патологические состояния, при которых имеется нарушенный возврат венозной крови, повреждение эндотелия или эндотелиальная дисфункция и гиперкоагуляционные нарушения.
В результате тромбоэмболии лёгочных артерий прекращается кровоснабжение лёгочной ткани, развивается некроз (отмирание тканей), возникает инфаркт-пневмония, дыхательная недостаточность. Увеличивается нагрузка на правые отделы сердца, развивается правожелудочковая недостаточность кровообращения: цианоз (посинение кожи), отёки на нижних конечностях, асцит (скопление жидкости в брюшной полости). Заболевание может развиваться остро или постепенно, в течение нескольких часов или дней. В тяжёлых случаях развитие ТЭЛА происходит стремительно и может привести к резкому ухудшению состояния и гибели больного.
Каждый год от ТЭЛА умирает 0,1% населения земного шара. По частоте смертельных исходов заболевание уступает только ИБС (ишемической болезни сердца) и инсульту. Больных ТЭЛА умирает больше, чем больных СПИДом, раком молочной, предстательной желез и пострадавших в дорожно-траспортных проишествиях вместе взятых. Большинству больным (90%), умершим от ТЭЛА, вовремя не был установлен правильный диагноз, и не было проведено необходимое лечение. ТЭЛА часто возникает там, где её не ожидают — у больных некардиологическими заболеваниями (травмы, роды), осложняя их течение. Смертность при ТЭЛА достигает 30%. При своевременном оптимальном лечении смертность может быть снижена до 2-8%. [2]
Симптомы ТЭЛА зависят от величины тромбов, внезапности или постепенного появления симптомов, длительности заболевания. Течение может быть очень разным — от бессимптомного до быстро прогрессирующего, вплоть до внезапной смерти.
ТЭЛА — болезнь-призрак, которая носит маски других заболеваний сердца или лёгких. Клиника может быть инфарктоподобная, напоминать бронхиальную астму, острую пневмонию. Иногда первым проявлением болезни является правожелудочковая недостаточность кровообращения. Главное отличие — внезапное начало при отсутствии других видимых причин нарастания одышки.
Этиология
ТЭЛА развивается, как правило, в результате тромбоза глубоких вен, который развивается обычно за 3-5 дней до начала заболевания, особенно при отсутствии антикоагулянтной терапии.
Факторы риска тромбоэмболии лёгочной артерии
При диагностике учитывают наличие факторов риска тромбоэмболии. Наиболее значимые из них: перелом шейки бедра или конечности, протезирование бедренного или коленного сустава, большая операция, травма или поражение мозга.
К опасным (но не столь сильно) факторам относят: артроскопию коленного сустава, центральный венозный катетер, химиотерапию, хроническую сердечную недостаточность, гормонзаместительную терапию, злокачественные опухоли, пероральные контрацептивы, инсульт, беременность, роды, послеродовой период, тромбофилию. При злокачественных новообразованиях частота венозной тромбоэмболии составляет 15% и является второй по значимости причиной смерти этой группы больных. Химиотерапевтическое лечение увеличивает риск венозной тромбоэмболии на 47%. Ничем не спровоцированная венозная тромбоэмболия может быть ранним проявлением злокачественного новообразования, которое диагностируется в течение года у 10% пациентов эпизода ТЭЛА. [2]
К наиболее безопасным, но всё же имеющим риск, факторам относят все состояния, сопряжённые с длительной иммобилизацией (неподвижностью) — длительный (более трёх суток) постельный режим, авиаперелёты, пожилой возраст, варикозное расширение вен, лапароскопические вмешательства. [3]
Некоторые факторы риска — общие с тромбозами артериального русла. Это те же факторы риска осложнений атеросклероза и гипертонической болезни: курение, ожирение, малоподвижный образ жизни, а также сахарный диабет, гиперхолестеринемия, психологический стресс, низкий уровень употребления овощей, фруктов, рыбы, низкий уровень физической активности.
Чем больше возраст больного, тем более вероятно развитие заболевания.
Наконец, сегодня доказано существование генетической предрасположенности к ТЭЛА. Гетерозиготная форма полиморфизма V фактора увеличивает риск исходных венозных тромбоэмболий в три раза, а гомозиготная форма — в 15-20 раз.
К наиболее значимым факторам риска, способствующим развитию агрессивной тромбофилии, относятся антифосфолипидный синдром с повышением антикардиолипиновых антител и дефицит естественных антикоагулянтов: протеина С, протеина S и антитромбина III.
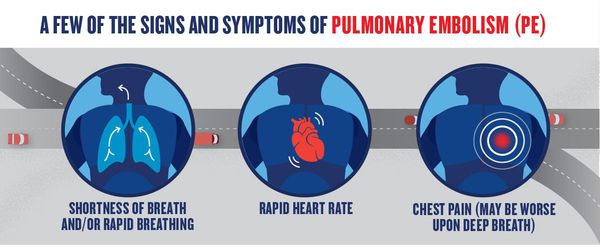
Симптомы тромбоэмболии легочной артерии
Симптомы заболевания разнообразны. Не существует ни одного симптома, при наличии которого можно было точно сказать, поставить диагноз ТЭЛА.
К признакам ТЭЛА относятся загрудинные инфарктоподобные боли, одышка, кашель, кровохарканье, артериальная гипотония, цианоз, синкопальные состояния (обмороки), что также может встречаться и при других различных заболеваниях.
Часто диагноз ставится после исключения острого инфаркта миокарда. Характерной особенностью одышки при ТЭЛА является возникновение её без связи с внешними причинами. Например, больной отмечает, что не может подняться на второй этаж, хотя накануне делал это без усилий. При поражении мелких ветвей лёгочной артерии симптоматика в самом начале может быть стёртой, неспецифичной. Лишь на 3-5 день появляются признаки инфаркта лёгкого: боли в грудной клетке; кашель; кровохарканье; появление плеврального выпота (скопление жидкости во внутренней полости тела). Лихорадочный синдром наблюдается в период от 2 до 12 дней.
Полный комплекс симптомов встречается лишь у каждого седьмого больного, однако 1-2 признака встречаются у всех пациентов. При поражении мелких ветвей лёгочной артерии диагноз, как правило, выставляется лишь на этапе образования инфаркта лёгкого, то есть через 3-5 суток. Иногда больные с хронической ТЭЛА длительное время наблюдаются у пульмонолога, в то время как своевременная диагностика и лечение позволяют уменьшить одышку, улучшить качество жизни и прогноз.
Поэтому с целью минимизации затрат на диагностику разработаны шкалы для определения вероятности заболевания. Эти шкалы считаются практически равноценными, но Женевская модель оказалась более приемлемой для амбулаторных пациентов, а шкала P.S.Wells — для стационарных. Они очень просты в использовании, включают в себя как основные причины (тромбоз глубоких вен, новообразования в анамнезе), так и клинические симптомы.
Параллельно с диагностикой ТЭЛА врач должен определить источник тромбоза, и это довольно трудная задача, так как образование тромбов в венах нижних конечностей часто протекает бессимптомно.
Патогенез тромбоэмболии легочной артерии
В основе патогенеза лежит механизм венозного тромбоза. Тромбы в венах образуются вследствие снижения скорости венозного кровотока из-за выключения пассивного сокращения венозной стенки при отсутствии мышечных сокращений, варикозном расширении вен, сдавлении их объёмными образованиями. На сегодняшний день врачи не могут поставить диагноз расширение вен малого таза (у 40% больных). Венозный тромбоз может развиваться при:
Тромбы могут быть обнаружены с помощью ультразвука. Опасными являются те, которые прикреплены к стенке сосуда и двигаются в просвете. Они могут оторваться и с током крови переместиться в лёгочную артерию. [1]
Гемодинамические последствия тромбоза проявляются при поражении свыше 30-50% объёма лёгочного русла. Эмболизация сосудов лёгких приводит к повышению сопротивления в сосудах малого круга кровообращения, повышению нагрузки на правый желудочек, формированию острой правожелудочковой недостаточности. Однако тяжесть поражения сосудистого русла определяется не только и не столько объёмом тромбоза артерий, сколько гиперактивацией нейрогуморальных систем, повышенным выбросом серотонина, тромбоксана, гистамина, что приводит к вазоконстрикции (сужению просвета кровеносных сосудов) и резкому повышению давления в лёгочной артерии. Страдает перенос кислорода, появляется гиперкапния (увеличивается уровень содержания углекислого газа в крови). Правый желудочек дилятируется (расширяется), возникает трикуспидальная недостаточность, нарушение коронарного кровотока. Снижается сердечный выброс, что приводит к уменьшению наполнения левого желудочка с развитием его диастолической дисфункции. Развивающаяся при этом системная гипотензия (снижение артериального давления) может сопровождаться обмороком, коллапсом, кардиогенным шоком, вплоть до клинической смерти.
Возможная временная стабилизация артериального давления создает иллюзию гемодинамической стабильности пациента. Однако через 24-48 часов развивается вторая волна падения артериального давления, причиной которой являются повторные тромбоэмболии, продолжающийся тромбоз вследствие недостаточной антикоагулянтной терапии. Системная гипоксия и недостаточность коронарной перфузии (прохождения крови) обусловливают возникновение порочного круга, приводящего к прогрессированию правожелудочковой недостаточности кровообращения.
Эмболы небольшого размера не ухудшают общего состояния, могут проявляться кровохарканьем, ограниченными инфаркт-пневмониями. [5]
Классификация и стадии развития тромбоэмболии легочной артерии
Существует несколько классификаций ТЭЛА: по остроте процесса, по объёму поражённого русла и по скорости развития, но все они сложны при клиническом применении.
По объёму поражённого сосудистого русла различают следующие виды ТЭЛА:
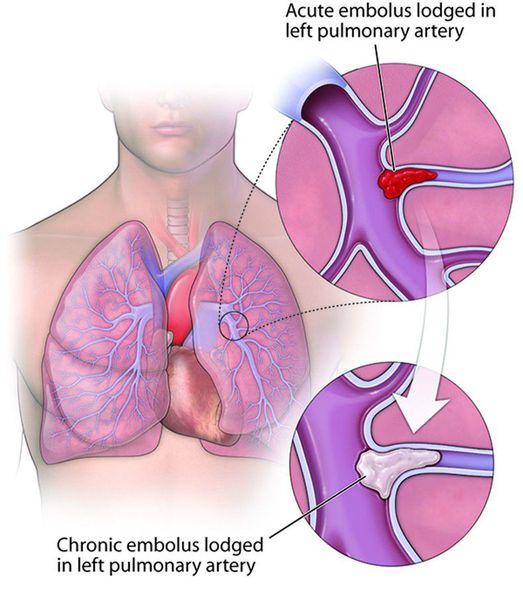
Клиническое течение ТЭЛА бывает острейшим («молниеносным»), острым, подострым (затяжным) и хроническим рецидивирующим. Как правило, скорость течения заболевания связана с объёмом тромбирования ветвей лёгочных артерий.
По степени тяжести выделяют тяжёлую (регистрируется у 16-35%), среднетяжёлую (у 45-57%) и лёгкую форму (у 15-27%) развития заболевания.
Большее значение для определения прогноза больных с ТЭЛА имеет стратификация риска по современным шкалам (PESI, sPESI), включающий 11 клинических показателей. На основании этого индекса пациент относится к одному из пяти классов (I-V), в которых 30-дневная летальность варьирует от 1 до 25%.
Осложнения тромбоэмболии легочной артерии
Острая ТЭЛА может служить причиной остановки сердца и внезапной смерти. При постепенном развитии возникает хроническая тромбоэмболическая лёгочная гипертензия, прогрессирующая правожелудочковая недостаточность кровообращения.
Хроническая тромбоэмболическая лёгочная гипертензия (ХТЭЛГ) — форма заболевания, при которой происходит тромботическая обструкция мелких и средних ветвей лёгочной артерии, вследствие чего повышается давление в лёгочной артерии и увеличивается нагрузка на правые отделы сердца (предсердие и желудочек).
ХТЭЛГ — уникальная форма заболевания, потому что может быть потенциально излечима хирургическими и терапевтическими методами. Диагноз устанавливается на основании данных катетеризации лёгочной артерии: повышения давления в лёгочной артерии выше 25 мм рт. ст., повышения лёгочного сосудистого сопротивления выше 2 ЕД Вуда, выявления эмболов в лёгочных артериях на фоне продолжительной антикоагулянтной терапии более 3-5 месяцев.
Тяжёлым осложнением ХТЭЛГ является прогрессирующая правожелудочковая недостаточность кровообращения. Характерным является слабость, сердцебиение, снижение переносимости нагрузок, появление отёков на нижних конечностях, накопление жидкости в брюшной полости (асцит), грудной клетке (гидроторакс), сердечной сумке (гидроперикард). При этом одышка в горизонтальном положении отсутствует, застоя крови в лёгких нет. Часто именно с такими симптомами пациент впервые попадает к кардиологу. Данные о других причинах болезни отсутствуют. Длительная декомпенсация кровообращения вызывает дистрофию внутренних органов, белковое голодание, снижение массы тела. Прогноз чаще всего неблагоприятный, возможна временная стабилизация состояния на фоне медикаментозной терапии, но резервы сердца быстро исчерпываются, отёки прогрессируют, продолжительность жизни редко превышает 2 года.
Диагностика тромбоэмболии легочной артерии
Методы диагностики ТЭЛА, применяемые к конкретным больным, зависят прежде всего от определения вероятности заболевания, тяжести состояния пациента и возможностей лечебных учреждений.
Для диагностики ТЭЛА используется следующий алгоритм:
Оценка клинической вероятности
При оценке вероятности ТЭЛА учитывают следующие факторы: операция или перелом в предшествующий месяц, злокачественная опухоль, возраст старше 65 лет, кровохарканье, боль в нижней конечности с одной стороны, высокая частота сердечных сокращений.
Анализы для диагностики ТЭЛА
Метод определения D-димера доказал свою высокую значимость при подозрении на ТЭЛА. Однако тест не является абсолютно специфичным, так как повышенные результаты встречаются и при отсутствии тромбоза, например, у беременных, пожилых людей, при фибрилляции предсердий, злокачественных новообразованиях. Поэтому пациентам с высокой вероятностью заболевания это исследование не показано. Однако при низкой вероятности тест достаточно информативен для исключения тромбообразования в сосудистом русле.
В случаях подозрения и при доказанности ТЭЛА дополнительными лабораторными исследованиями являются сердечные маркеры:
Компьютерная томография
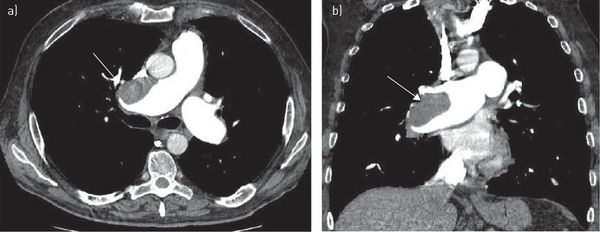
Компьютерная томография грудной клетки с контрастированием сосудов — высокодоказательный метод диагностики тромбоэмболии лёгочной артерии. Позволяет визуализировать как крупные, так и мелкие ветви лёгочной артерии.
При невозможности выполнения КТ грудной клетки (беременность, непереносимость йодсодержащих контрастных веществ и т.д.) возможно выполнение планарной вентиляционно-перфузионной (V/Q) сцинтиграфии лёгких. Этот метод может быть рекомендован многим категориям больных, однако на сегодняшний день он остаётся малодоступным.
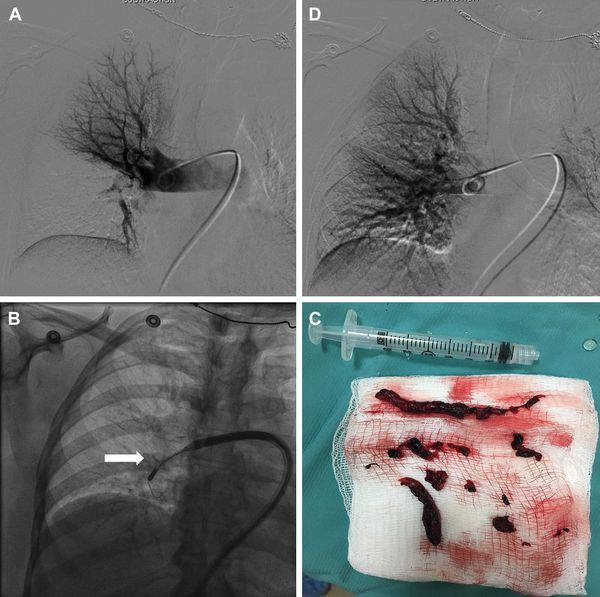
Зондирование правых отделов сердца и ангиопульмонография является наиболее информативным в настоящее время методом. С его помощью можно точно определить как факт эмболии, так и объём поражения. [6]
К сожалению, не все клиники оснащены изотопными и ангиографическими лабораториями. Но выполнение скрининговых методик при первичном обращении пациента — ЭКГ, обзорная рентгенография грудной клетки, УЗИ сердца, УЗДГ вен нижних конечностей — позволяет направить больного на МСКТ (многосрезовую спиральную компьютерную томографию) и дальнейшее обследование.
ЭКГ при ТЭЛА
На первом месте по своей диагностической значимости среди инструментальных методов обследования находится электрокардиография, которая должна выполняться всем пациентам. Патологические изменения на ЭКГ — остро возникшая перегрузка правого предсердия и желудочка, сложные нарушения ритма, признаки недостаточности коронарного кровотока — позволяют заподозрить заболевание и выбрать правильную тактику, определяя тяжесть прогноза.
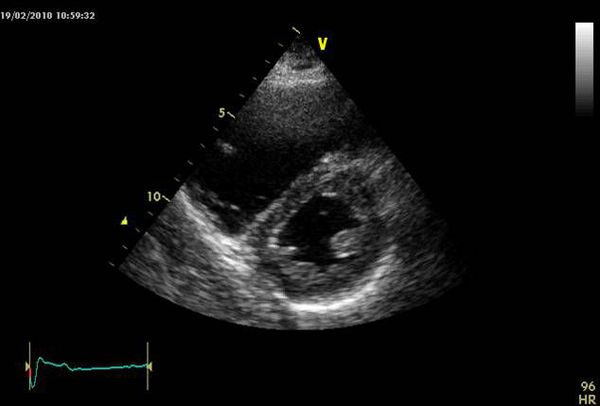
Оценка размеров и функции правого желудочка, степени трикуспидальной недостаточности по ЭХОКГ позволяет получить важную информацию о состоянии кровотока, давлении в лёгочной артерии, исключает другие причины тяжёлого состояния пациента, такие как тампонада перикарда, диссекцию (рассечение) аорты и другие. Однако это не всегда выполнимо в связи с узким ультразвуковым окном, ожирением пациента, невозможностью организовать круглосуточную службу УЗИ, часто с отсутствием чрезпищеводного датчика.
УЗИ при ТЭЛА
Для определения тромбоза глубоких вен высокую чувствительность и специфичность имеет УЗИ вен нижних конечностей, которое для скрининга может проводиться в четырёх точках: паховых и подколенных областях с обеих сторон. Увеличение зоны исследования повышает диагностическую ценность метода.
Лечение тромбоэмболии легочной артерии
Основная цель лечения при тромбоэмболии лёгочной артерии — сохранение жизни больного и профилактика формирования хронической лёгочной гипертензии. В первую очередь для этого необходимо остановить процесс тромбообразования в лёгочной артерии, который, как уже говорилось выше, происходит не одномоментно, а в течение нескольких часов или дней.
Методы лечения ТЭЛА в острую фазу:
Подбор схем приёма препаратов при системном тромболизисе проводит врач, они могут отличаться в зависимости от состояния пациента.
Хирургические процедуры
Для лечения ТЭЛА высокого риска при массивном тромбозе показано восстановление проходимости закупоренных артерий — хирургическая тромбэктомия, так как это приводит к нормализации гемодинамики.
Для определения стратегии лечения и риска смерти в настоящее время предпочтительными шкалами в ранний период ТЭЛА являются шкалы PESI и sPESI, но только при лечении ТЭЛА низкого риска и у пациентов со стабильной гемодинамикой.