что такое кондиционирование в отделении трансплантации костного мозга
Целью уничтожения клеток крови является, во-первых, создание пространства для нового костного мозга, во-вторых, предотвращение возможности рецидива после пересадки костного мозга, в-третьих, уничтожение здоровых клеток крови, чтобы они не распознали донорский костный мозг как чужеродный и пытались его отторгнуть.
В зависимости от основного заболевания, в Германии применяются три различные формы кондиционирования:
Облучение всего тела в Германии
Облучение в Германии проводится в специализированном отделении лучевой терапии. В отделении подробно разъясняют пациенту побочные эффекты и риски лучевой терапии. Перед облучением на теле пациента маркируют поля облучения. Любая маркировка может быть удалена с кожи только с разрешения медицинских сотрудников. Даже принимая душ, необходимо следить за маркировкой на коже, стараясь не повредить её. Для предотвращения возникающей тошноты используется специальный медикамент, действующий целый день.
Химиотерапия в Германии
В зависимости от назначенного протокола химиотерапии ее длительность в Германии варьируется от трех до семи дней. Время введения каждой ежедневной дозы, в зависимости от медикамента, от 1 до 6 часов. Во время сеанса химиотерапии в Германии пациент подключен к монитору, который позволяет постоянно следить за состоянием пациента. Однако, кроме мониторирования, врачам очень важно знать о состоянии пациента от него самого. Поэтому нужно обращаться к персоналу клиники, если что-то беспокоит. К побочным явлениям химиотерапии относятся: быстрая утомляемость, слабость, выпадение волос (волосы перед кондиционированием лучше коротко постричь), тошнота и рвота, понос, воспаление слизистой оболочки рта, покраснение кожи.
Пациенты, которым проводится пересадка костного мозга в Германии от неродственного донора во время подготовительной терапии получают препарат из белка кролика, облегчающий приживление чужеродного костного мозга и предотвращающий реакцию «трансплантат-против-хозяина». При этом возможно возникновение лихорадки и озноба.
Спасибо! Мы получили Вашу заявку на консультацию.
Если Вы хотите оформить Запрос на лечение, продолжите заполнение. Располагая всеми необходимыми данными, мы сможем подобрать наилучшее решение Вашей проблемы в максимально короткие сроки
Что такое кондиционирование в отделении трансплантации костного мозга
Режимом кондиционирования называется подготовка больного с помощью цитостатической и лучевой терапии к инфузии аутологичных или аллогенных гемопоэтических стволовых клеток.
Существует два принципиальных подхода при назначении режима кондиционирования перед трансплантацией гемопоэтических стволовых клеток: миелоаблативное и немиелоаблативное воздействие. При этом все известные режимы кондиционирования обладают этими свойствами в разной степени и находятся в диапазоне от немиелоаблативного до миелоаблативного эффекта. Примеры воздействия различных комбинаций цитостатических препаратов, используемые в качестве режимов кондиционирования, представлены в таблице.
Дозы цитостатических препаратов и лучевой терапии, используемые в качестве режимов кондиционирования, приведены в таблицах.
При ауто-трансплантации гемопоэтических стволовых клеток режим кондиционирования включает, как правило, миелоаблативные или близкие к ним дозы цитостатических препаратов либо лучевой терапии для полной эрадикации кроветворения (нормального и злокачественного клонов) пациента перед инфузией аутологичных гемопоэтических стволовых клеток.

Полная замена кроветворения реципиента на гемопоэз донора при алло-трансплантации гемопоэтических стволовых клеток осуществляется с помощью цитостатического и иммунологического воздействия, баланс внутри которых определяется дозой цитостатических препаратов, степенью иммуносупрессии и клеточным составом трансплантата. От уровня иммуносупрессии реципиента зависят скорость приживления гемопоэтических стволовых клеток донора и вероятность развития первичной «реакции отторжения» трансплантата.
До сих пор не разработано идеального режима кондиционирования, в основе которого находилась бы комбинация лучевой терапии и цитостатических препаратов, обладающих максимально высокими противоопухолевым и иммуносупрессивным эффектами у реципиента, без каких-либо проявлений органотоксичности. Наиболее часто встречающиеся токсические осложнения существующих режимов кондиционирования хорошо изучены, их тяжесть зависит от возраста реципиента (менее выражены у детей и подростков), генетической предрасположенности, общего состояния (индекс Карновского), стадии заболевания в момент трансплантации (рецидив, ремиссия).
При алло-трансплантациии гемопоэтических стволовых клеток используют миелоаблативные режимы кондиционирования и достаточно часто режимы кондиционирования с уменьшенной интенсивностью дозы (R1 — HSCT — reduce intensity — hematopoietic stem cell transplantation, «мини-трансплантат», «немиелоаблативные»), особенности которых учитывают при назначении определенной схемы подготовки пациента перед трансплантацией.
До последнего времени миелоаблативные режимы кондиционирования были основой успеха при проведении алло-трансплантации гемопоэтических стволовых клеток. Миелоаблативным режимом кондиционирования называется использование комбинации доз цитостатических препаратов или лучевой терапии для достижения полной эрадикации кроветворения (нормального и злокачественного клонов) и иммуноаблативного эффекта у реципиента перед введением аллогенных гемопоэтических стволовых клеток.
Режимом кондиционирования с уменьшенной интенсивностью дозы («немиелоаблативные») называется назначение комбинации немиелоаблативных, но иммуноаблативных доз цитостатических препаратов или лучевой терапии для достижения высокой степени иммуносупрессии при неполной эрадикации кроветворения (нормального и злокачественного клонов) реципиента перед введением донорских гемопоэтических стволовых клеток.
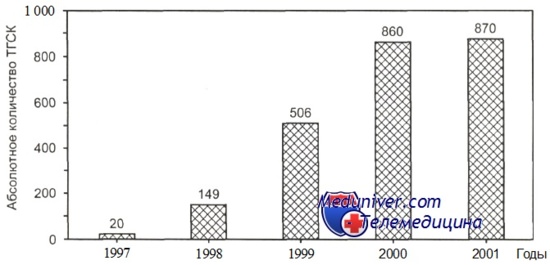
Внедрение «немиелоаблативных» режимов кондиционирования приобрело актуальность по следующим причинам:
— наличие большого количества тяжелых осложнений, связанных с органотоксичностью при назначении цитостатических препаратов в миелоаблативных дозах;
— сложность применения миелоаблативных режимов кондиционирования у пациентов старше 50 лет и низким индексом Карновского;
— относительно высокая частота развития рецидивов основного заболевания после алло-трансплантации гемопоэтических стволовых клеток, несмотря на использование цитостатических препаратов в максимальных дозах, и, следовательно, невозможность преодоления резистентности злокачественного клона клеток путем наращивания доз;
— появление экспериментальных и клинических данных, свидетельствующих о наличии иммунологической реакции «трансплантат против опухоли (лейкоза/лимфомы/миеломы/солидной опухоли)».
Внедрение «немиелоаблативных» режимов кондиционирования стало возможным в связи с появлением новых цитостатических препаратов — аналогов пуриновых оснований (флударабин, 2-CDA), оказывающих выраженное иммуносупрессивное действие. Эти препараты создают условия для развития абсолютной иммунологической толерантности в организме реципиента, что позволяет использовать гемопоэтические стволовые клетки, полученные из различных источников (родственные, неродственные доноры, ПК) и с различной степенью совместимости по HLA-системе (полностью, частично совместимые, гаплоидентичные).
Миелоаблативные режимы кондиционирования
Достижение полного «химеризма» (100 % приживления гемопоэтических стволовых клеток донора) у реципиента после режимов кондиционирования с уменьшенной интенсивностью дозы происходит медленнее по сравнению с миелобластными дозами с минимальными проявлениями органотоксичности, что расширяет возрастной диапазон для применения алло-трансплантациии гемопоэтических стволовых клеток. Другим преимуществом режимов кондиционирования с уменьшенной интенсивностью дозы является то, что комбинация цитостатического и в большей степени иммунологического воздействия на лейкозный клон клеток может быть высокоэффективной при резистентных формах заболевания. Создание этих схем подготовки реципиента и первые данные, свидетельствующие в пользу возможности достижения успеха, ведут к ежегодному росту количества алло-трансплантации гемопоэтических стволовых клеток с использованием режимов кондиционирования с уменьшенной интенсивностью дозы.
Выбор комбинации различных цитостатических препаратов и лучевой терапии перед трансплантацией гемопоэтических стволовых клеток зависит от возраста реципиента, индекса Карновского, источника трансплантируемых клеток (аллогенный, аутологичный), степени совместимости по HLA-системе между донором и реципиентом, типа и стадии болезни (злокачественные заболевания системы крови, солидные опухоли, апластическая анемия, генетические заболевания или рецидив, ремиссия), а также собственного опыта работы центра трансплантации.
Применение лучевой терапии в режиме кондиционирования обусловлено способностью тотального облучения тела (ТОТ) вызывать выраженный миело- и иммуноаблативный эффект. Включение тотального облучения тела (ТОТ) в режим кондиционирования обсуждается при проведении трансплантации гемопоэтических стволовых клеток у больных ОЛЛ, лимфомами, множественной миеломой, а также при выполнении неродственной алло-трансплантации гемопоэтических стволовых клеток и трансплантации от частично совместимого или гап-лоидентичного донора. Манипулирование дозой ТОТ также позволяет достигнуть состояния иммуно-аблативного воздействия без миелоаблативного эффекта, что создает условия для создания «немиелоаблативных» режимов кондиционирования на его основе.
Однако, несмотря на преимущества тотального облучения тела (ТОТ), связанные с высокими проявлениями иммуносупрессии и профилактикой развития рецидивов заболевания (в первую очередь нейролейкемии), невозможность проведения тотального облучения тела (ТОТ) у больных с гемобластозами по тем или иным причинам не исключает применения режимов кондиционирования, полностью основанных на цитостатических препаратах с той же степенью эффективности.
Для достижения максимального иммуносупрессивного воздействия возможно дополнительное включение в режим кондиционирования антилимфоцитарного (антитимоцитарного) глобулина (АЛГ/ АТГ). Введение АЛГ/АТГ в режим кондиционирования служит мерой для профилактики первичного «отторжения» трансплантата и развития острой РТПХ при проведении родственной и неродственной алло-трансплантации гемопоэтических стволовых клеток, а также при алло-трансплантации гемопоэтических стволовых клеток от частично совместимого или гаплоидентичного донора. Этот эффект связан с длительной персистенцией препарата в плазме крови (до 7 дней) и двусторонним повреждающим эффектом АЛГ/АТГ (до 120 дней) на лимфоидную популяцию клеток реципиента и лимфоциты, присутствующие во введенном трансплантате (Т-клеточное «истощение» in vivo).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Трансплантация костного мозга и стволовых клеток
Общие принципы
ОБЩАЯ ИНФОРМАЦИЯ О СТВОЛОВЫХ КРОВЕТВОРНЫХ КЛЕТКАХ
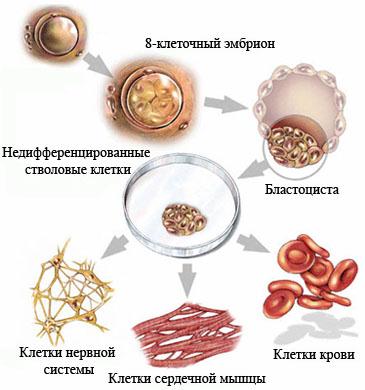
Недифференцированная стволовая клетка, происходящая из бластоцисты, является родоначальницей всех клеток организма, в том числе и стволовой кроветворной клетки (СКК).
Основными свойствами стволовой кроветворной клетки являются возможность дифференцироваться в направлении любого из ростков кроветворения и способность к самоподдержанию.
 Колонии стволовых кроветворных клеток (электронная микроскопия) |  Мононуклеарная фракция, обогащенная клетками CD34, окрашена по Маю-Грюнвальду с докраской по Гимзе. Стволовые клетки, несущие маркер CD34, внешне напоминают малые и средние лимфоциты. |
ИСТОРИЧЕСКАЯ СПРАВКА
Первые работы, посвященные терапевтическому использованию костного мозга, были выполнены в последней декаде XIX века, независимо друг от друга Brown-Sequard, d»Arsonval, Fraser, Billings и Hamilton, которые применяли экстракт костного мозга животных для лечения больных различными видами анемий. Несмотря на положительный эффект, отмеченный всеми авторами, в течение последующих пятидесяти лет использование данной методики носило спорадический характер и не выходило за рамки клинического эксперимента до 1937 года когда Schretzenmayr впервые произвел парентеральное (внутримышечное) введение костного мозга, а в 1939 году Osgood выполнил первое внутривенное введение костного мозга.
Результаты экспериментальных исследований привели клиницистов к идее использования ТКМ при заболеваниях, связанных с поражением костного мозга (лейкозы, апластическая анемия), а также при радиационных воздействиях и проведении химиотерапии, однако основные теоретические и практические проблемы проведения ТКМ удалось преодолеть в 60-е годы. С этого времени ТКМ является одним из методов лечения различных заболеваний крови и иммунной системы.
ВИДЫ ТРАНСПЛАНТАЦИИ КОСТНОГО МОЗГА
Разновидностью АллоТКМ является сингенная ТКМ (трансплантация от однояйцевого близнеца).
ПОКАЗАНИЯ К ТРАНСПЛАНТАЦИИ КОСТНОГО МОЗГА
С развитием появлением колониестимулирующих факторов и развитием технологий клеточной сепарации с 70-х годов для получения гемопоэтических клеток крови вмести костного мозга стали использовать стволовые клетки периферической крови.
Применение клеточных сепараторов значительно упростило проведение процедуры получения стволовых клеток крови, уменьшило число осложнений связанных с дачей наркоза и травматическим повреждения костной ткани.
Еще одним потенциальным источником СКК является пуповинная кровь, основным преимуществом которой является меньшая иммуногенность, однако малое количество стволовых клеток в материале ограничивает ее применение и используется преимущественно в педиатрии или у пациентов с массой тела до 50 кг.
Методика проведения миелотрансплантации различается в зависимости от ее вида (аллогенная или аутологичная), нозологической формы заболевания и ряда других факторов.
ПРАКТИЧЕСКИЕ АСПЕКТЫ МИЕЛОТРАНСПЛАНТАЦИИ
ОПРЕДЕЛЕНИЕ ПОКАЗАНИЙ И ПРОТИВОПОКАЗАНИЙ
Наиболее частыми показаниями к ТКМ/ТСКК являются онкогематологические и гематологические заболевания (лейкозы, злокачественные лимфомы, апластическая анемия, врожденные иммунодефициты и нарушения метаболизма).
Чаше всего ТКМ или ТСКК проводится во время полной ремиссии (ПР), частичной ремиссии (ЧР) или при рецидиве опухоли, чувствительном к химиотерапии. При первичной резистентности к цитостатической терапии результаты ТКМ резко ухудшаются, поэтому в этих случаях операция выполняется относительно редко.
ВЫБОР ДОНОРА
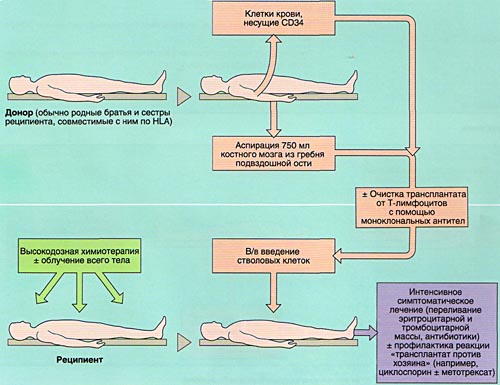
Совместимость костного мозга определяет результаты АллоТКМ. Родственными донорами считаются совместимые по системе HLA братья или сестры реципиента (сибсы). Родители и дети гаплоидентичны (имеют одну общую хромосому из каждой пары, т. е. совпадают между собой на 50%) и не могут быть донорами аллогенного костного мозга. Совместимые сибсы имеются лишь у 20-25% больных, в связи с чем в последние 10 лет активно внедряется АллоТКМ от неродственных HLA-идентичных доноров или частично совместимых родственных доноров.
МОБИЛИЗАЦИЯ, ОБРАБОТКА И ИНФУЗИЯ СТВОЛОВЫХ КРОВЕТВОРНЫХ КЛЕТОК
 А) |  Б) |
А) специальный сосуд (дюар) с жидким азотом для транспортировки контейнеров с костным мозгом
Б) извлеченный из сосуда контейнер с костным мозгом
Инфузия аллогенного, размороженного аутологичного костного мозга или СКК периферической крови проводится внутривенно, капельно после предварительного введения антигистаминных препаратов для предотвращения аллергических реакций.
ИММУНОСУПРЕССИВНАЯ ТЕРАПИЯ (КОНДИЦИОНИРОВАНИЕ)
ПРОФИЛАКТИКА И ЛЕЧЕНИЕ ОСЛОЖНЕНИЙ ПЕРИОДА ЦИТОПЕНИИ
Вскоре после окончания кондиционирования и введения СКК у больного развивается аплазия костного мозга (период отсутствия костного мозгового кроветворения), которая проявляется практически полным отсутствием клеток крови (панцитопенией) и продолжается в среднем 4 недели. Этот период опасен развитием тяжелых осложнений (инфекции, кровоточивость и т.д.).
Основную опасность в периоде цитопении представляют инфекционные осложнения, поэтому их профилактика, своевременное и адекватное лечение являются необходимым условием успешной ТКМ.
Также по показаниям проводится переливание компонентов крови (эритроцитарная масса, тромбомасса, плазма).
Приживление костного мозга или СКК периферической крови констатируют по результатам анализа костного мозга. Вскоре количество нейтрофилов достигает > 0,5*109/л, а тромбоцитов > 20>
Трансплантация гемопоэтических клеток при лечении детей с онкологическими заболеваниями
Широко известна как трансплантация костного мозга, трансплантация стволовых клеток или ТГСК
Что такое трансплантация гемопоэтических клеток?
Трансплантация гемопоэтических клеток — это медицинская процедура, которая проводится для лечения различных заболеваний, в том числе рака у детей. Она позволяет заменить поврежденные или разрушенные кроветворные (гемопоэтические) клетки здоровыми.
Поскольку основным источником кроветворных клеток является костный мозг, эта процедура часто называется трансплантацией костного мозга. По мере усовершенствования методики стал более распространен термин «трансплантация гемопоэтических клеток». Оба термина часто используются как взаимозаменяемые. Некоторые также называют этот процесс трансплантацией стволовых клеток.
С помощью трансплантации можно успешно лечить некоторые виды рака у детей, однако она имеет серьезные побочные эффекты и отдаленные последствия. Этот метод следует применять с осторожностью. Перенести трансплантацию нелегко. Это сопряжено с физическими и эмоциональными трудностями как для пациента, так и для его семьи. Однако в лечащую группу, осуществляющую трансплантацию, входит много людей, готовых поддерживать пациентов и членов их семей на протяжении всего процесса. Многие дети и подростки, перенесшие трансплантацию, сейчас живут полноценной жизнью, у них больше нет рака.
Роль костного мозга и кроветворных клеток
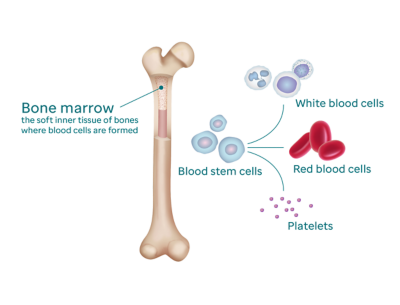
Костный мозг — это мягкий губчатый материал, находящийся в центре большинства костей нашего тела. В костном мозге содержится большое количество кроветворных (гемопоэтических) клеток.
Гемопоэтические клетки являются предшественниками всех других клеток крови. В результате их созревания образуются:
Костный мозг работает подобно заводу по производству клеток крови, постоянно создавая новые гемопоэтические клетки, чтобы эритроциты, лейкоциты и тромбоциты, циркулирующие в крови, могли выполнять свою функцию.
Все эритроциты и тромбоциты производятся в костном мозге, так же как и 70% лейкоцитов. (Оставшиеся 30% лейкоцитов производятся в селезенке, лимфатических узлах и тимусе.)
Очень малое количество гемопоэтических стволовых клеток такжеможетнаходиться в периферической (циркулирующей) крови. Еще одним источником кроветворных клеток является пуповинная кровь.
Детские онкологические заболевания, которые лечатся методом трансплантации
В детской онкологии трансплантация в первую очередь проводится при лечении лейкозов, как правило, при отсутствииэффекта от стандартноголечения. Лейкоз, злокачественное заболевание крови и костного мозга,заставляеторганизм производить поврежденные лейкоциты, в результате чего развивается тяжелая болезнь.
Иногда трансплантация проводится и при лечении других онкологических заболеваний. Примерами могут служить нейробластома, множественная миелома, рецидивирующая саркома Юинга и рецидивирующая опухоль Вильмса.
Кроме того, трансплантация может проводиться в ходе лечения пациентов со злокачественными опухолями мягких тканей или головного мозга, которые требуют проведения химиотерапии или лучевой терапии в очень высоких дозах.
Виды трансплантатов
В основном выделяют два вида трансплантатов:
При аллогенной трансплантации поврежденные или разрушенные клетки крови заменяют здоровыми клетками другого человека. Эти клетки могут быть взяты от донора или из пуповинной крови. Донор может быть родным братом или сестрой, другим членом семьи или человеком, не являющимся родственником.
Кроветворные клетки забирают из костного мозга, пуповинной крови или периферической (циркулирующей) крови донора.
Кондиционирование при трансплантации
Пациенту, получающему донорские клетки, будет назначена терапия для угнетения его иммунной системы. Такая терапия называется иммуносупрессивной. Она заключается в применении высокодозной химиотерапии в сочетании с лучевой терапией или без нее. Иммуносупрессивная терапия борется сраком,уничтожает иммунную систему пациента и создает пространство для роста донорских клеток в костном мозге.
Инфузия донорских клеток
Донорские клетки вводят через вену, этот процесс очень похож на переливание крови. По кровотоку клетки находят путь к центру длинных костей. Этот процесс необходим для восстановления способности организма вырабатывать здоровые эритроциты, лейкоциты и тромбоциты.
Поддерживающая терапия
Пациентам проводят поддерживающую терапию с использованием препаратов крови, антибиотиков, противовирусных препаратов и, в некоторых случаях, иммуносупрессивных препаратов для профилактики возникновения реакции «трансплантат против хозяина» (РТПХ).
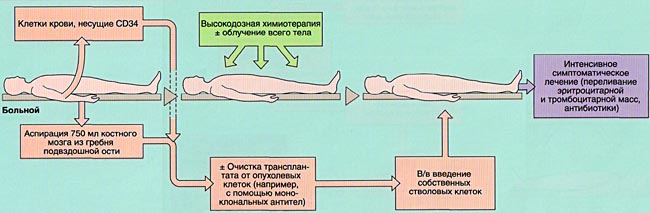
При аутологичной трансплантации используются собственные клетки пациента для восстановления способности производить эритроциты, лейкоциты и тромбоциты после проведения высокодозной химиотерапии в сочетании с лучевой терапией или без нее. Клетки пациента заблаговременно берут из периферической (циркулирующей) крови или костного мозга и подвергают криоконсервации (замораживанию) для последующего использования.
Как берут клетки
Существует два способа взятия кроветворных клеток у пациента — аферез и взятие костного мозга.
Аферез
Может проводиться мобилизация клеток из костного мозга в периферическую кровь с помощью химиотерапии с последующим введением гранулоцитарного колониестимулирующего фактора (Г-КСФ). У некоторых пациентов мобилизация клеток проводится только с помощью Г-КСФ. Затем пациенту проводится процедура взятия этих клеток — аферез.
Взятие костного мозга
Также может проводиться взятие костного мозга для сбора кроветворных клеток непосредственно из него. Эта процедура может проводиться в любое время после достижения нормального уровня лейкоцитов.
После сбора методом афереза или взятия костного мозга клетки замораживают для последующего использования, когда врачи решат провести трансплантацию.
Перед трансплантацией пациент проходит обследование на наличие инфекционных заболеваний и возможности проведения трансплантации.
Во время трансплантации пациент получает высокие дозы химиотерапии изолированно или в сочетании с лучевой терапией для уничтожения злокачественных клеток, что в свою очередь нарушает выработку клеток крови. Без трансплантации у пациента не возобновится рост собственных эритроцитов, лейкоцитов и тромбоцитов.
Пациенту внутривенно вводят собственные клетки. Этот процесс очень похож на переливание крови. По кровотоку клетки находят путь к центру длинных костей. Этот процесс необходим для восстановления способности организма вырабатывать собственные эритроциты, лейкоциты и тромбоциты.
В период ожидания трансплантации кроветворных клеток пациенту могут вводить препараты крови, антибиотики и противовирусные препараты.
Исследования, необходимые для проведения трансплантации
Процедура трансплантации — тяжелое физическое испытание. Сначала врачи определят, является ли пациент подходящим кандидатом. Для этого рассматриваются такие факторы:
Для оценки работы сердца могут применяться различные методы, например эхокардиография (ЭхоКГ).
Чтобы убедиться в том, что трансплантат приживется, также проводится обследование сердца, легких, почек и других жизненно важных органов пациента. Как правило, назначают следующие исследования:
Если это не было выполнено ранее, пациенту будет установлен центральный катетер, чтобы исключить необходимость частых уколов.
Семья пациента также встретится с социальным работником или психологом, чтобы обсудить эмоциональное благополучие, а также с финансовым консультантом, чтобы обсудить вопросы страхования и финансовые вопросы.
Поиск донора
Поиск донора координируется сотрудниками отделения трансплантации. Как правило, в первую очередь рассматривают родных братьев и сестер, так как гемопоэтические клетки донора и пациента должны иметь похожие генетические маркеры. Этими маркерами служат белки — так называемые лейкоцитарные антигены человека (HLA). Чтобы определить, подходит ли донор по HLA, необходимо выполнить анализ на HLA. Для этого берут образцы крови пациента и потенциального донора. В некоторых случаях для анализа может использоваться образец эпителия со слизистой оболочки внутренней поверхности щеки. Затем клетки отправляют в лабораторию.
Так как эти генетические маркеры передаются по наследству от родителей, совпадение с братом или сестрой наиболее вероятно. Если пациент и его брат или сестра имеют одних биологических родителей, то каждый брат или сестра имеет 25%-ю вероятность совпадения с пациентом по HLA. Следовательно, примерно у 70% пациентов среди братьев и сестер не будет подходящего донора.
Если братья и сестры не подходят, врачи будет проводить поиск неродственного донора или единицы пуповинной крови (если центр трансплантации выполняет трансплантацию пуповинной крови) с помощью реестра Be the Match® Национальной программы доноров костного мозга. Примерно для 30% пациентов находят подходящего неродственного донора.
Если найти идеально совпадающего донора невозможно, врач может предложить использование материала от донора с близким, но не полным совпадением по HLA. Такие трансплантации выполняются достаточно широко и во многих случаях проходят успешно.
Если для пациента невозможно найти подходящего донора с близким совпадением, в некоторых случаях можно использовать костный мозг или гемопоэтические клетки от «наполовину совместимого» члена семьи. Это называется трансплантацией костного мозга от идентичного по гаплотипу (наполовину совместимого) донора.
Скрининг
Доноры также не должны иметь медицинских противопоказаний для донорства. С помощью реестра Be the Match донорский центр проводит проверку потенциального донора на наличие следующих заболеваний:
Взятие донорских клеток
Кроветворные клетки могут брать из костного мозга, периферической (циркулирующей) крови и из донорской пуповинной крови. Этот процесс называется сбором.
Если клетки для трансплантации получают из костного мозга, процедура их сбора называется взятием костного мозга. Донору проводится общая (когда пациент спит во время процедуры) либо проводниковая анестезия (когда происходит потеря чувствительности ниже пояса). Через кожу в тазовую кость и костный мозг вводят иглы для взятия кроветворных клеток. Процедура взятия костного мозга занимает около часа.
Взятый костный мозг затем подвергают обработке с целью удаления крови и костных фрагментов. При аутологичной трансплантации клетки, взятые из костного мозга, смешивают с консервантом и замораживают, чтобы сохранить их живыми до момента использования. Эта техника называется криоконсервацией. Кроветворные клетки могут находиться в криоконсервированном состоянии в течение многих лет.
Если кроветворные клетки, необходимые для трансплантации, получают из циркулирующей крови, этот процесс называется аферезом или лейкаферезом. За несколько дней до афереза донору или пациенту могут назначить препарат — гранулоцитарный колониестимулирующий фактор, Г-КСФ, чтобы стимулировать производство в костном мозге большего числа гемопоэтических клеток и выделения их в кровоток.
При аферезе кровь берут из крупной вены на руке или через центральный венозный катетер (гибкую трубку, установленную в крупную вену в области шеи, грудной клетки или паха). Кровь проходит через аппарат, который отделяет гемопоэтические клетки. Затем оставшуюся кровь возвращают в организм донора. Как правило, аферез длится от 4 до 6 часов.
Приаутологичнойтрансплантации клетки пациента замораживают до момента использования. Приаллогеннойтрансплантации донорские клетки подвергают обработке и в свежем виде вводят пациенту как можно скорее после взятия.
Кроветворные клетки также могут брать из пуповинной крови. Для этого мать должна обратиться в банк пуповинной крови до рождения ребенка. Банк пуповинной крови может предложить ей заполнить анкету и сдать небольшой образец крови.
Банки пуповинной крови могут быть государственными или частными. Банки пуповинной крови принимают донорскую пуповинную кровь и могут предоставлять донорские клетки подходящим пациентам, нуждающимся в трансплантации. Частные банки пуповинной крови хранят пуповинную кровь для семьи на случай, если она потребуется ребенку или другому члену семьи. Семья должна оплатить сбор и хранение пуповинной крови. В заявлении Американской педиатрической академии за 2017 г. касательно хранения пуповинной крови для возможной трансплантации в будущем указано, что «соотношение затрат и полезности частных банков пуповинной крови не оправдано данными об их использовании в настоящее время».
После рождения ребенка и отсечения пуповины осуществляется взятие крови из пуповины и плаценты. Если мать согласна, пуповинная кровь подвергается обработке и замораживанию в банке пуповинной крови.
Как осуществляется трансплантация
Многие пациенты считают, что трансплантация — это сложная хирургическая процедура, но сама по себе трансплантация представляет собой относительно простой процесс. Он очень похож на переливание крови. Донорские клетки находятся в пакете или шприце, подключенном через трубку к центральному катетеру пациента. Процедура длится от нескольких минут до нескольких часов и не вызывает болезненных ощущений.
После попадания в кровоток гемопоэтические клетки достигают костного мозга, где начинают делиться и превращаться в лейкоциты, эритроциты и тромбоциты. Этот процесс называется приживлением. Приживление, как правило, происходит в течение 2–4 недель (при использовании пуповинных клеток — дольше). На полное восстановление иммунной системы может уйти от нескольких месяцев при аутологичной трансплантации (с использованием собственных клеток пациента) до 6 месяцев или года при аллогенной трансплантации (с использованием клеток родственного или неродственного донора).
Чего ожидать во время госпитализации
На период госпитализации ребенка, который может длиться 4–6 недель или дольше, требуется пребывание с ним одного из родителей или другого взрослого члена семьи. Пациентам может потребоваться пребывание в специальном отделении больницы, предназначенном для пациентов, проходящих трансплантацию, и, возможно, для пациентов с частичным или полным иммунодефицитом. В этом отделении проводятся особые мероприятия по контролю инфекций.
Лучше всего, если родители будут сменять друг друга при уходе за ребенком, так как уход утомителен как физически, так и морально. Если присутствие родителей невозможно, следует рассмотреть участие других членов семьи. Это следует планировать заранее, так как каждое ухаживающее лицо должно пройти соответствующее обучение.
Если родители работают, им следует объяснить работодателю процесс трансплантации костного мозга и свои обязанности в качестве основного ухаживающего за ребенком лица.
На начальном этапе госпитализации пациентам проводится высокодозная химиотерапия — изолированно или в сочетании с лучевой терапией.
Химиотерапия (и облучение, если оно применяется) борется с опухолевыми клетками и в то же время создает пространство для здоровых донорских клеток. Она также ослабляет иммунную систему пациента для профилактики отторжения донорских клеток. Пациенты должны соблюдать меры предосторожности для профилактики инфекций, такие как ношение маски и частое мытье рук.
Кроме того, лица, пребывающие с пациентом или навещающие его, проходят проверку на возможные инфекции и контагиозные заболевания. Правила в разных центрах могут отличаться, поэтому семье пациента следует уточнить распорядок в своей клинике.
Сначала это может показаться пугающим, но лечащая группа старается обеспечить детям максимальный комфорт. Пациенты могут приносить с собой определенные игрушки и другие предметы, чтобы сделать обстановку более домашней. Специалисты по адаптации могут проводить развлекательные мероприятия, например игры или занятия творчеством. Реабилитологи помогают пациентам выполнять физические упражнения и дают рекомендации по поддержанию активного образа жизни.
Пребывание вдали от семьи, друзей и привычного образа жизни может быть тяжелым испытанием, поэтому детям и подросткам рекомендуется общаться с помощью текстовых сообщений, социальных сетей, видеочатов, электронной почты, телефонных звонков и писем.
Пациенты, которым проводится трансплантация, не могут посещать школу во время госпитализации, однако при желании они могут выполнять учебные задания. Ухаживающим лицам следует обратиться в школу, а также узнать о школьной программе центра трансплантации или программе взаимодействия со школой.
Как узнать, успешна ли трансплантация
Врачи оценивают результаты различных анализов крови, чтобы подтвердить выработку новых клеток крови (приживление трансплантата) и отсутствие рецидива. После трансплантации у пациентов ежедневно берут кровь для анализа в лаборатории. Врачи подсчитывают количество эритроцитов, лейкоцитов и тромбоцитов в организме. Благодаря ежедневному подсчету врачи и пациенты могут отслеживать прогресс. В зависимости от индивидуальных особенностей время приживления трансплантата может различаться. Как правило, процесс занимает от двух недель до месяца. Первыми приживляются лейкоциты, затем — эритроциты, а после — тромбоциты. Пациентам может потребоваться переливание эритроцитов и тромбоцитов для поддержания их достаточного количества в период приживления трансплантата.
Пункция костного мозга (извлечение небольшого образца костного мозга с помощью иглы с целью исследования под микроскопом) также позволяет врачам оценить работу кроветворных клеток и достижение ремиссии.
После выписки из больницы
Когда пациент покидает отделение трансплантации, его иммунитет все еще ослаблен и ему сложно бороться с инфекциями. Некоторые из них могут представлять угрозу жизни. После выписки пациенту потребуется домашний уход, пока его иммунная система придет в норму. Этот процесс может занимать от нескольких месяцев до года.
Если семья проживает недалеко, пациент может вернуться домой. В противном случае семье пациента придется поселиться в специальном социальном жилье, расположенном возле больницы. В течение первых нескольких недель пациент должен часто приходить на приемы в больницу. Семья должна быть готова оставаться там на целый день. Врач осмотрит пациента и, возможно, назначит анализы или процедуры. Спустя некоторое время, при отсутствии проблем или осложнений, пациенту можно будет посещать больницу не так часто. При каждом посещении клиники родители должны приносить с собой все лекарства пациента.
Даже после выписки домой пациент должен соблюдать повышенные меры предосторожности из-за риска инфекций.
Пациент должен продолжать проходить все процедуры контроля инфекционных заболеваний, которые он начал проходить в отделении трансплантации, если врач не одобрит их прекращения. Каждый центр трансплантации имеет собственные установленные правила, которым нужно следовать.
Пациенты могут принимать много лекарств. Эти препараты жизненно важны для здоровья пациента. Соблюдайте следующие рекомендации:
Подготовка временного основного ухаживающего лица
Немедленно сообщите персоналу клиники трансплантации о смене основного лица, ухаживающего за пациентом. Желательно планировать замену заранее. Все ухаживающие лица должны получить необходимые инструкции.
Возможные осложнения/побочные эффекты
Существует два состояния, которые вызывают наиболее серьезные побочные эффекты и отдаленные последствия: отторжение трансплантата и реакция «трансплантат против хозяина» (РТПХ).
Отторжение трансплантата происходит, когда иммунная система пациента распознает донорские клетки как чужеродные и уничтожает их. Так как высокодозная химиотерапия, которая проводится во время трансплантации, уничтожает кроветворные клетки пациента, они не могут самостоятельно восстанавливаться. Пациенты, у которых происходит отторжение трансплантата, могут серьезно заболеть и, в некоторых случаях, погибнуть от осложнений лечения. Для профилактики отторжения трансплантата пациент проходит химиотерапию, изолированно или в сочетании с облучением, для подавления иммунной системы перед трансплантацией. Если происходит отторжение трансплантата, может быть выполнена вторая процедура трансплантации или назначено другое лечение.
Реакция «трансплантат против хозяина» (РТПХ) — это частое осложнение трансплантации с использованием донорских клеток. У 20–50% пациентов, которым выполняется трансплантация донорских клеток, развивается реакция «трансплантат против хозяина». РТПХ не возникает у пациентов, которым проводится трансплантация собственных клеток. РТПХ — это осложнение, которое может возникать после аллогенной трансплантации (от родственного или неродственного донора). Она развивается, когда лейкоциты донора распознают организм пациента как чужеродный. Эти лейкоциты атакуют ткани пациента так, как если бы они боролись с инфекцией.
В большинстве случаев эта реакция имеет легкую или умеренную степень тяжести и со временем пропадает. Однако РТПХ может протекать тяжело и даже угрожать жизни.
РТПХ легче предотвратить, чем лечить. Меры профилактики, как правило, заключаются в назначении после трансплантации препаратов, которые снижают иммунную реакцию, таких как циклоспорин, такролимус, метотрексат, микофенолата мофетил или стероиды. Также перед введением донорских клеток из них могут извлекаться некоторые Т-лимфоциты.
Существует два типа РТПХ.
РТПХ классифицируется как острая, если она развивается в течение первых 100 дней после трансплантации. Заболевание, как правило, поражает печень, желудочно-кишечный тракт и кожу. К симптомам острой РТПХ относятся сыпь, диарея и пожелтение кожи и глаз вследствие повышенного уровня билирубина.
Хроническая РТПХ, как правило, развивается примерно спустя три месяца после трансплантации, хотя в некоторых случаях она может не проявляться в течение года или более. Она возникает у 10–40% пациентов.
Симптомы более разнообразны, чем при острой РТПХ, и напоминают некоторые аутоиммунные заболевания. Хроническая РТПХ может быть легкой, умеренной или тяжелой.
Химиотерапия и лучевая терапия, которые применяются при подготовке к трансплантации, могут вызывать мукозит (язвы на слизистой всего желудочно-кишечного тракта), который проявляется язвами в полости рта, эзофагитом (нарушения глотания), язвами желудка или диареей, сопровождающейся спазмами. Иногда пациентам требуется внутривенное введение обезболивающих и полное парентеральное питание (ППП) или установка назогастрального зонда для введения питания.
Инфекционные осложнения относятся к наиболее серьезным побочным эффектам. Опасные для жизни инфекции могут развиваться примерно у 30% пациентов, перенесших трансплантацию аллогенных донорских клеток (от родственного или неродственного донора). Частота ниже среди пациентов, перенесших аутологичную трансплантацию (с использованием собственных кроветворных клеток пациента). Пациентам нужно будет проходить регулярные обследования на наличие инфекций и получать препараты, снижающие риск их развития. Пациентам, перенесшим аллогенную трансплантацию, вероятно, будет назначена специальная диета. В некоторых случаях для диагностики и лечения осложнений может потребоваться проведение хирургических процедур.
Может появиться красная выступающая сыпь на шее, ушах, туловище, ладонях и стопах. Могут образоваться волдыри. В тяжелых случаях может отслаиваться кожа. Может возникать сильный зуд. Как правило, для лечения назначают стероиды, например преднизон.
Проблемы с желудком могут проявляться болью в животе, сильной диареей, потерей аппетита и тошнотой/рвотой.
Наиболее частым серьезным осложнением со стороны печени является веноокклюзионная болезнь. Пациенты с повреждениями печени, гепатитом или патологиями высокого риска в анамнезе имеют повышенный риск веноокклюзионной болезни, хотя это заболевание может развиваться у любого пациента после трансплантации. Веноокклюзионная болезнь характеризуется повышением концентрации билирубина (что вызывает пожелтение кожи и глаз), увеличением печени и задержкой жидкости или увеличением массы тела. Методами лечения веноокклюзионной болезни часто становятся ограничение потребления жидкости и назначение препарата дефибротида. В качестве профилактики пациенту может назначаться урсодиол или гепарин, а также ежедневный контроль массы тела и баланса жидкости во время госпитализации. Веноокклюзионная болезнь может протекать тяжело и в худших случаях приводить к смерти.
Через несколько недель после госпитализации для проведения трансплантации вследствие химиотерапии или реакции «трансплантат против хозяина» могут начать выпадать волосы. Это происходит медленно, в течение нескольких дней.
Некоторые химиотерапевтические препараты могут вызывать судороги. Пациентам, получающим эти препараты, могут назначаться лекарства для профилактики судорог.
Еще одним осложнением является боль. Мукозит (язвы в полости рта) может быть очень болезненным. Циклоспорин и другие препараты, которые назначаются для профилактики или лечения РТПХ, могут вызывать нейропатическую боль. Прием обезболивающих и немедикаментозное лечение могут облегчить боль и помочь пациентам справиться с ней.
Пневмония, или воспаление легких, может вызываться бактериями, вирусами или грибками. Пациенты находятся под пристальным наблюдением и могут получать препараты для профилактики определенных инфекций, например цитомегаловирусной (ЦМВ).
Частым побочным эффектом является повышенная утомляемость. Пациентам следует регулярно выполнять физические упражнения, чаще отдыхать и полноценно питаться.
Когда обращаться к врачу?
Ухаживающие лица должны обратиться к врачу по месту жительства, либо к врачу или практикующей медсестре отделения трансплантации, если у пациента появятся один или несколько из следующих симптомов:
Эмоциональные последствия
Вследствие физических побочных эффектов и изоляции от семьи, друзей и привычной жизни у пациентов могут наступать периоды грусти или депрессии. Чувство грусти в течение дня или двух — это нормально, но если такое состояние длится дольше, пациенту следует обратиться к кому-то из сотрудников больницы. Это могут быть врач, медсестра или, возможно, социальный работник, священник, психолог или специалист по адаптации.
Отдаленные последствия
Некоторые осложнения, связанные с трансплантацией, известны как отдаленные последствия, так как они не проявляются раньше чем через несколько месяцев или даже лет после лечения. Большинство проблем со временем проходит, но некоторые из них могут носить постоянный характер и требовать длительного наблюдения.
К отдаленным последствиям трансплантации относятся:
Ни у кого из пациентов все эти проблемы не развиваются одновременно. Риск возникновения проблем после трансплантации зависит от заболевания, типа трансплантации, возраста и истории предшествующего лечения. Многие осложнения можно предотвратить с помощью правильного контроля и мер профилактики. Очень большое значение имеют регулярные посещения врача.
Пациенты в течение длительного времени после трансплантации находятся под наблюдением с целью отслеживания побочных эффектов. Пациенты, которым проводилось облучение всего тела при подготовке к трансплантации, имеют риск эндокринных нарушений, таких как гипотиреоз, надпочечниковая недостаточность или дефицит гормона роста. Важно регулярно измерять рост и массу тела пациента, а также при необходимости наблюдаться у эндокринолога.
Рецидив: если рак возникает повторно
В некоторых случаях после трансплантации онкологическое заболевание может вернуться (рецидивировать). Вероятность рецидива максимальна в первый год после трансплантации, и со временем риск снижается. Лечащая группа, выполнявшая трансплантацию, продолжит заботиться о пациенте и рассмотрит другие варианты лечения. Это может быть участие в клинических исследованиях или повторная трансплантация.
—
Дата изменения: июнь 2018 г.
Иммунитет, болезнь и инфекции
Иммунная система защищает организм от инфекций. Сеть специальных клеток, тканей и органов защищает организм от различных «захватчиков» — микроорганизмов.
Долгосрочные эффекты и отдаленные последствия
Лечение рака у детей, такое как химиотерапия, облучение и хирургическое вмешательство, может иногда вызывать отдаленные последствия у бывших пациентов.