гиперэхогенные включения в мозге ребенка
Роль НСГ при бактериальном менингите у грудных детей
Колесниченко Ю.Ю., врач УЗД, www.uzgraph.ru
УЗИ головного мозга(НСГ) это очень важный метод диагностики при бактериальном менингите.
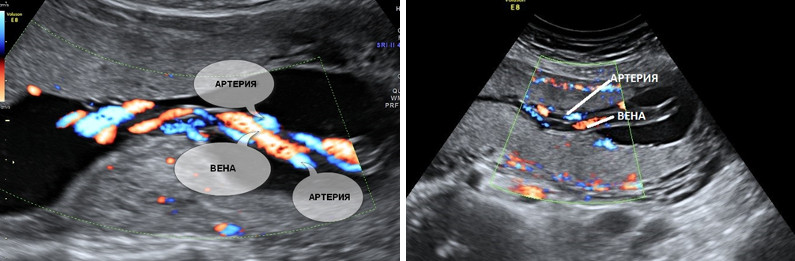
Бактериальный менингит(БМ) часто встречается у детей в возрасте до 4 недель(20 на 100тыс.), развивается стремительно и приводит к смерти в 50% случаев. Вызывается он разными бактериями, чаще всего это кишечная палочка, стрептококк агалактия, пневмококк, менингококк; чаще гематогенным путем при генерализованной инфекции(сепсис). Обычно инфекция садится на сосудистые сплетения боковых желудочков, а также на мелкие сосуды субарахноидального пространства, вызывая воспалительную реакцию, которая переходит на твердую и мягкую мозговые оболочки, а затем ведет к отеку мозга. Из-за повреждения сосудов могут формироваться внутрисосудистые тромбы, в том числе в венозных синусах и вене Галена, оклюзия сосудов ведет к инсультам различной локализации.
УЗИ(НСГ) является методикой номер один при подозрении на БМ, также с помощью НСГ можно следить за процессом лечения и осложнениями.
Радиологические находки при БМ обычно представлены очагами гипоксически-ишемического изменения мозга, очагами лейкомаляции, гидроцефалией.
При неосложненном БМ данные НСГ могут быть нормальными. НСГ при БМ выявляет отклонения в 65% случаев в острой фазе инфекции, а при тяжелой неврологической симптоматике уже в 100% случаев.
К выявляемым на НСГ изменениям относятся:
— расширение борозд и повышение эхогенности поверхности мозга(в 60%);
— расширение субарахноидальных сосудов;
— расширение субконвекситального пространства(субарахноидального и субдурального по причине скопления воспалительного эксудата);
— локальные скопления жидкости(в субарахноидальном и субдуральном пространствах), принимающих вид гигром или эмпиемы, в частности из-за отслойки твердой мозговой оболочки. Около 5% таких гигром далее инфицируются и становятся эмпиемой, в этих случаях на НСГ они становятся гетероэхогенными, часто с формированием взвеси и так называемых «уровней» жидкости. Отложение фибрина приводит к формированию в этом конгломерате изолированных жидкостных включений. Данные изолированные включения важны с точки зрения того, что они воспринимаются, как бактериальные резервуары, и говорят о тщетности терапии, в связи с малой вероятностью прохождения лекарства в эти резервуары и требуется доставка в эти резервуары лекарства через субдуральную пункцию;
— одно- или двухсторонняя вентрикуломегалия(в 30%);
— повышение эхогенности внутрижелудочкового ликвора, также с «уровнями» жидкости;
— расширение сосудистых сплетений и повышение их эхогенности;
— вентрикулит(неровный контур желудочков и сосудистых сплетений, уровни жидкости и взвесь в желудочках);
— отек мозга(повышение эхогенности борозд и ткани мозга, сглаживание извилин, повышение ИР более 0,8);
— гипоксически-ишемические очаговые изменения мозга(гиперэхогенные включения или гетероэхогенные включения при маляции);
Также в статье много эхограмм с примерами описанной эхосемиотики.
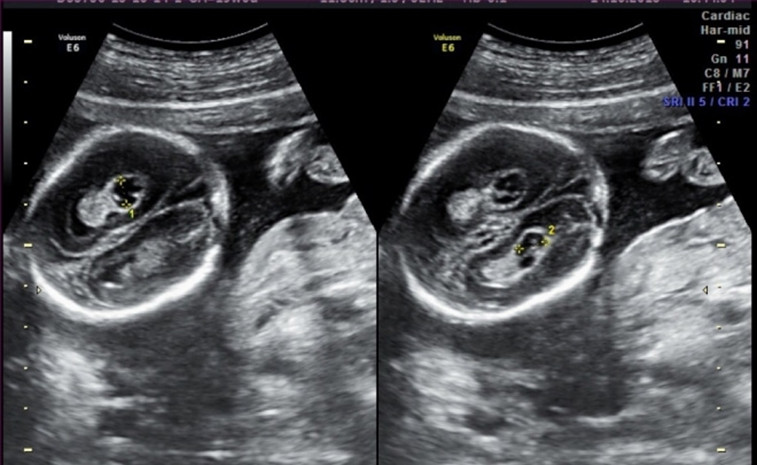
Гиперэхогенные включения в мозге ребенка
Цель работы: основной целью настоящего исследования явилось изучение особенностей поражения центральной нервной системы у недоношенных новорожденных детей с внутриутробными ДНК-вирусными инфекциями (цитомегаловирусной, герпесвирусной) различного гестационного
возраста.
Материал и методы исследования
Работа выполнена в период 2008–2011 гг. в отделениях анестезиологии, реанимации и интенсивной терапии и недоношенных детей Научно-исследовательского института педиатрии им. К.Я. Фараджевой. Недоношенные дети поступали в стационар НИИ Педиатрии из родильных домов г. Баку и районов Азербайджана. Всего обследовано 270 недоношенных детей различного гестационного возраста. Исходя из выбранных критериев, недоношенные дети по гестационному возрасту были разделены на 2 подгруппы: подгруппа А – недоношенные дети со сроком гестационного возраста 32–37 недель (68 детей). Подгруппа В – недоношенные дети со сроком гестационного возраста 29–31 неделя (34 детей).
На основании нижеследующих критериев в исследование включены: недоношенные дети с гестационным возрастом до 37 недель; масса тела при рождении не более 2500 г; поступление в отделения анестезиологии реанимации и интенсивной терапии и для недоношенных детей в течение первых 3–5 суток жизни; наличие неврологической симптоматики. На основании полученных данных и с учетом гестационного возраста недоношенные дети были подразделены на 3 соответствующие группы:
I группа – недоношенные дети с ЦМВИ в количестве n = 41 (подгруппы А (n = 27) и В (n = 14).
II группа – недоношенные дети с ГВИ в количестве n = 32 (подгруппы А (n = 21) и В (n = 11).
III группа – недоношенные дети со смешанной вирусной инфекцией (ЦМВИ + ГВИ) в количестве n = 29, подгруппы (А (n = 20) и В (n = 9)).
IV группа – условно-здоровые недоношенные с гестационным возрастом 32–36 недель (n = 30).
Для решения поставленных в работе задач были использованы следующие методы исследования: клинические, инструментальные, биохимические, иммунологические, серологические, молекулярно-биологические. Всем новорожденным проводилась нейросонография в первые двое суток пребывания в стационаре, т.е. на 1–7 сутки жизни. Определялся кровоток по передней мозговой артерии. Эхографическое исследование проводилось на аппаратах «Medison X6», «Aloka SSD-1400» с микроконвексным линейным датчиком 5 МГц. Наряду с системным клиническим наблюдением и дополнительными методами обследования проводился комплекс специфических методов исследования. Диагностику ВУИ осуществляли методом полимеразно-цепной реакции (ПЦР), реакцией непрямой иммунофлюоресценции, методом иммуноферментного анализа (ИФА), определяя уровень специфических к ЦМВИ, ГВИ антител M и G класса. Полученные результаты обрабатывали методом t-критерия Фишера-Стьюдента, критерия хи-квадрат и критерия U-Уилкоксона.
Результаты исследования и их обсуждение
Для установления факторов риска возникновения перинатальных поражений ЦНС у недоношенных новорожденных был проведен ретроспективный анализ соматического и акушерско-гинекологического анамнеза 132 матерей. В результате обследования было выявлено, что наиболее значимыми факторами риска реализации внутриутробной инфекции, способствующими рождению недоношенных новорожденных с перинатальным поражением ЦНС, являются отягощенный акушерско-гинекологический анамнез, медицинские аборты в анамнезе женщины (85,2 %), воспалительные заболевания репродуктивной системы (42,2 %), экстрагенитальная патология (57 %). Высокая частота неблагоприятного преморбидного фона, осложненного акушерско-гинекологического анамнеза, сочетается с высокой частотой осложненного течения беременности и родов: угроза прерывания беременности (32,4 %), гестоз (27,5 %), анемия (40,2 %).
Частота выявления внутриутробных вирусных инфекций у недоношенных детей
Новорожденные с цитомегаловирусной и со смешанной инфекцией в частотности со сроком гестации 29–31 неделя чаще имели дыхательные расстройства тяжелой степени, чаще находились на ИВЛ и в реанимационном отделении. При анализе неврологического статуса наиболее часто у недоношенных детей при вирусных инфекциях у 75 (73,5 ± 4,4 %) выявлено перинатальное гипоксически-ищемическое поражение ЦНС; в I-й группе 68,3 ± 7,3 %; во II-й 81,2 ± 6,9 %; в III-й 72,4 ± 8,3 % соответственно. Легкая степень перинатального гипоксическо-ишемического поражения ЦНС при внутриутробных вирусных инфекциях клинически проявлялась синдромом угнетения, в некоторых случаях у недоношенных наблюдалось гипервозбудимость с легким гипертензионным синдромом. Легкая степень перинатального гипоксическо-ишемического поражения ЦНС наблюдалось у 18 недоношенных детей, что составило 17,6 ± 3,8 % от общего количества исследованных недоношенных детей (102) с внутриутробными вирусными инфекциями. Средняя степень тяжести выявлена у 22 (21,6 ± 14,1 %) недоношенных детей. В клинической картине наблюдались синдром угнетения, периодическое апноэ, судороги, вегетовисцеральные нарушения, гипотония. У некоторых детей отмечались гипервозбудимость, гипертензионный синдром. При тяжелой степени, наблюдаемой у 35 (34,3 ± 4,3 %) недоношенных с перинатальным гипоксически-ишемическим поражением ЦНС, при вирусных инфекциях клинически отмечались: синдром угнетения; у некоторых детей – ступор; также отмечались приступы апноэ; судороги; гипотония, гипертензионный синдром; наблюдались вегетовисцеральные нарушения. У 25 (24,5 ± 4,3 %) детей был отмечен синдром повышенной возбудимости, достоверно чаще наблюдаемый у детей с ЦМВИ и со смешанной вирусной инфекцией (22,0 ± 6,5 и 34,5 ± 8,8 % соответственно).
Синдром угнетения отмечался у 75 недоношенных детей, что составило 73,5 ± 4,4 % случаев; чаще наблюдаемый у детей I группы 85,4 ± 5,5 % (χ2 = 4,62; p Примечание: статистическая значимая разница с показателями контрольной группы * – р
Гиперэхогенные включения в мозге ребенка
Если у Вашего плода найдены ультразвуковые маркёры
Если при ультразвуковом исследовании найдены маркеры хромосомной патологии плода
Самые часто встречающиеся ультразвуковые маркеры хромосомной аномалии:
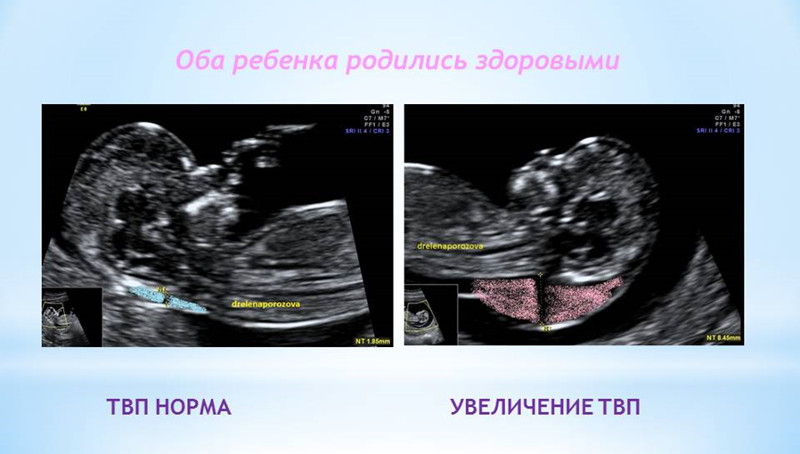
1. Увеличение ТВП.
Оценка этого параметра проводится в первое скрининговое УЗИ (11-14 недель)
ТВП (толщина воротникового пространства) может оказаться больше нормы по нескольким причинам.
Почему у плода может выявляться увеличение ТВП?
Родители бывают крайне взволнованы и хотят сразу же получить ответы на все, возникающие у них вопросы – с чем связано, что делать и многие другие. Вопросы, на которые невозможно ответить сразу. Ведь причин увеличения ТВП множество. Данная находка может встречаться у абсолютно здоровых плодов, это не порок развития, это лишь сигнал к более глубокому обследованию, потому что такая особенность может иметь место у плодов с хромосомной патологией, аномалиями сердца либо другими врожденными или наследственными заболеваниями. При увеличении максимального порога ТВП ВАЖНО, чтобы врач оценил все остальные ультразвуковые маркеры (признаки), а также провел детальную оценку анатомии плода. Возможно, причина увеличения ТВП кроется в нарушении развития плода (например, аномалии строения сердца).
Что делать при выявлении увеличения ТВП у плода?
Если у вашего плода обнаружили расширение ТВП, Вас обязательно направят на консультацию к врачу генетику, который собрав анамнез, оценив все риски, даст рекомендации по дополнительным методам исследования (инвазивная диагностика). Далее потребуется экспертное УЗИ плода на сроке 20 недель для детальной оценки анатомии. Если по всем этим исследованиям отклонений не выявлено, то шансы родить здорового ребенка велики даже при значительной величине ТВП.
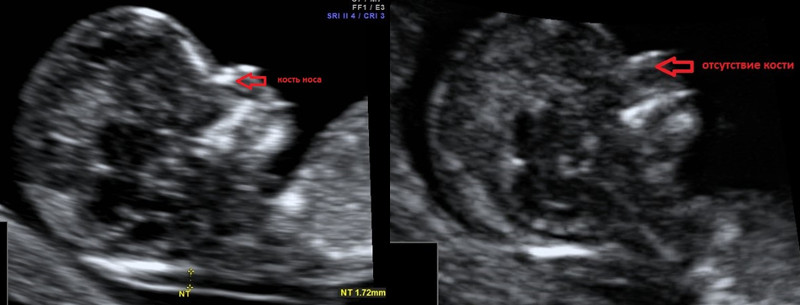
2. Гипоплазия\аплазия костей носа.
Гипоплазия костей носа – уменьшение размеров косточки носа в зависимости от КТР вашего малыша.
Аплазия костей носа – отсутствие визуализации косточки носа у вашего малыша.
Отсутствие видимости костной части спинки носа у плода или ее недоразвитие (недостаточно яркая) на первом скрининге связана с задержкой отложения кальция. Такая ситуация несколько чаще может встречаться у плодов с синдромом Дауна, однако важно, что:
3. Гиперэхогенный кишечник.
Это термин, говорящий о повышенной эхогенности (яркости) кишечника на ультразвуковом изображении. Выявление гиперэхогенного кишечника НЕ является пороком развития кишечника, а просто отражает характер его ультразвукового изображения. Необходимо помнить, что эхогенность нормального кишечника выше, чем эхогенность соседних с ним органов (печени, почек, легких), но такой кишечник не считается гиперэхогенным. Гиперэхогенным называется только такой кишечник, эхогенность которого сравнима с эхогенностью костей плода.
Почему кишечник у плода может быть гиперэхогенным?
Иногда гиперэхогенный кишечник выявляется у абсолютно нормальных плодов, и при УЗИ в динамике этот признак может исчезать. Повышенная эхогенность кишечника может быть проявлением хромосомных болезней плода, в частности, синдрома Дауна. В связи с этим при обнаружении гиперэхогенного кишечника проводится тщательная оценка анатомии плода. Однако при выявлении гиперэхогенного кишечника можно говорить лишь о повышенном риске синдрома Дауна, так как подобные изменения могут встречаться и у совершенно здоровых плодов. Иногда гиперэхогенный кишечник может быть признаком внутриутробной инфекции плода. Гиперэхогенный кишечник часто обнаруживается у плодов с задержкой внутриутробного развития. Однако при этом будут обязательно выявляться отставание размеров плода от срока беременности, маловодие и нарушение кровотока в сосудах плода и матки. Если ничего из вышеперечисленного не выявлено, то диагноз задержки развития плода исключен.
Что делать при выявлении гиперэхогенного кишечника у плода?
Вам следует обратиться к специалисту генетику, который еще раз оценит результаты биохимического скрининга и даст необходимые рекомендации по дальнейшему ведению беременности.
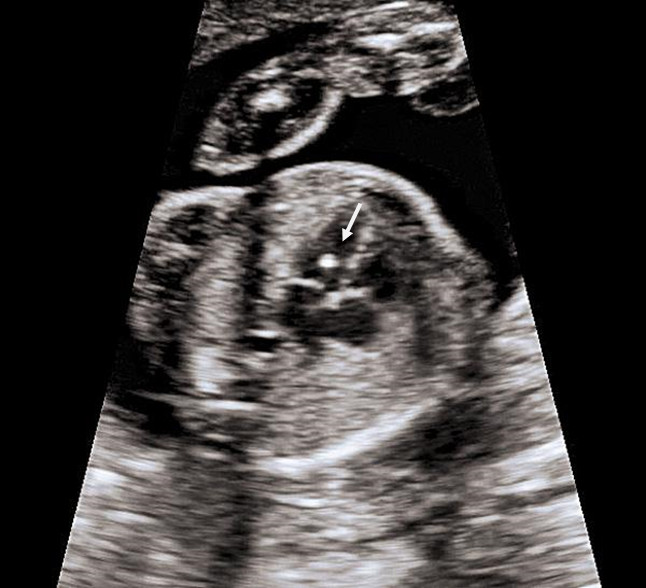
4. Гиперэхогенный фокус в желудочке сердца.
Это термин, говорящий о повышенной эхогенности (яркости) небольшого участка сердечной мышцы на ультразвуковом изображении. Выявление гиперэхогенного фокуса в сердце НЕ является пороком развития сердца, а просто отражает характер его ультразвукового изображения. Гиперэхогенный фокус возникает в месте повышенного отложения солей кальция на одной из мышц сердца, что не мешает нормальной работе сердца плода и не требует никакого лечения.
Почему у плода может выявляться гиперэхогенный фокус в сердце?
Иногда гиперэхогенный фокус в сердце выявляется у абсолютно нормальных плодов, и при УЗИ в динамике этот признак может исчезать. Наличие гиперэхогенного фокуса в сердце плода может быть проявлением хромосомных болезней плода, в частности, синдрома Дауна. В связи с этим при обнаружении гиперэхогенного фокуса проводится тщательная оценка анатомии плода. Однако этот маркер относится к «малым» маркерам синдрома Дауна, поэтому выявление только гиперэхогенного фокуса в сердце не повышает риск наличия синдрома Дауна и не является показанием к проведению других диагностических процедур.
Что делать при выявлении гиперэхогенного фокуса в сердце плода?
Если у плода выявлен ТОЛЬКО гиперэхогенный фокус в сердце, то никаких дополнительных обследований не требуется; риск болезни Дауна не увеличивается. На плановом УЗИ в 32-34 недели еще раз будет осмотрено сердце плода. В большинстве случаев гиперэхогенный фокус в сердце исчезает к этому сроку беременности, но даже если он продолжает оставаться в сердце, это никак не влияет на здоровье плода и тактику ведения беременности.
5. Единственная артерия пуповины.
Нормальная пуповина состоит из трех сосудов – две артерии и одна вена. Иногда вместо двух артерий в пуповине формируется только одна артерия и одна вена, таким образом, в пуповине определяется всего два сосуда. Данное состояние считается пороком развития пуповины, однако этот порок не оказывает никакого влияния на послеродовое состояние ребенка и его дальнейшее развитие.
Почему у плода может определяться единственная артерия пуповины?
Иногда единственная артерия пуповины выявляется у абсолютно нормальных плодов; после рождения ребенка данный факт не оказывает никакого влияния на его дальнейшее развитие. Иногда единственная артерия пуповины сочетается с пороками сердечно-сосудистой системы плода, поэтому при выявлении единственной артерии пуповины проводится детальный осмотр анатомии плода и, в частности, сердечно-сосудистой системы. При отсутствии других пороков развития единственная артерия пуповины в состоянии обеспечить адекватный кровоток плода. Несколько чаще единственная артерия пуповины выявляется у плодов с синдромом Дауна и другими хромосомными болезнями. Однако этот маркер относится к «малым» маркерам синдрома Дауна, поэтому выявление только единственной артерии пуповины не повышает риск наличия синдрома Дауна и не является показанием к проведению других диагностических процедур. Единственная артерия пуповины иногда приводит к возникновению задержки внутриутробного развития плода. В связи с этим при обнаружении единственной артерии пуповины рекомендуется дополнительное УЗИ в 26-28 недель беременности, и плановое в 32-34 недели. Если отставание размеров плода от срока беременности или нарушение кровотока в сосудах плода и матки не выявлено, то диагноз задержки развития плода исключен.
Что делать при выявлении единственной артерии пуповины у плода?
Выявление только единственной артерии пуповины не повышает риск наличия синдрома Дауна и не является показанием к консультации генетика и проведению других диагностических процедур. Необходимо контрольное УЗИ в 26-28 и 32 недели беременности для оценки темпов роста плода и оценки его функционального состояния.
6. Кисты сосудистых сплетений (КСС).
Часто ли встречаются кисты сосудистых сплетений?
В 1-2 % всех нормальных беременностей плоды имеет КСС, в 50 % случаев обнаруживаются двусторонние кисты сосудистых сплетений, в 90 % случаев кисты самопроизвольно исчезают к 26-ой неделе беременности, число, размер, и форма кист могут варьировать, кисты также найдены у здоровых детей и взрослых. Несколько чаще кисты сосудистых сплетений выявляются у плодов с хромосомными болезнями, в частности, с синдромом Эдвардса (трисомия 18, лишняя 18 хромосома). Однако, при данном заболевании у плода всегда будут обнаруживаться множественные пороки развития, поэтому выявление только кист сосудистого сплетения не повышает риск наличия трисомии 18 и не является показанием к проведению других диагностических процедур. При болезни Дауна кисты сосудистых сплетений, как правило, не выявляются. Риск синдрома Эдвардса при обнаружении КСС не зависит от размеров кист и их одностороннего или двустороннего расположения. Большинство кист рассасывается к 24-28 неделям, поэтому в 28 недель проводится контрольное УЗИ. Однако, если кисты сосудистых сплетений не исчезают к 28-30 неделям, это никак не влияет на дальнейшее развитие ребенка.
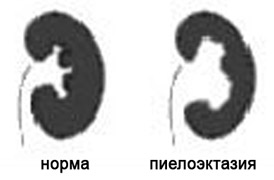
7. Расширение почечных лоханок (пиелоэктазия).
Почечные лоханки это полости, где собирается моча из почек. Из лоханок моча перемещается в мочеточники, по которым она поступает в мочевой пузырь.
Пиелоэктазия представляет собой расширение почечных лоханок. Пиелоэктазия в 3-5 раз чаще встречается у мальчиков, чем у девочек. Встречается как односторонняя, так и двухсторонняя пиелоэктазия. Легкие формы пиелоэктазии проходят чаще самостоятельно, а тяжелые иногда требуют хирургического лечения.
Причина расширения почечных лоханок у плода.
Если на пути естественного оттока мочи встречается препятствие, то моча будет накапливаться выше данного препятствия, что будет приводить к расширению лоханок почек. Пиелоэктазия у плода устанавливается при обычном ультразвуковом исследовании в 18-22 недели беременности.
Опасна ли пиелоэктазия?
Умеренное расширение почечных лоханок, как правило, не влияет на здоровье будущего ребенка. В большинстве случаев при беременности наблюдается самопроизвольное исчезновение умеренной пиелоэктазии. Выраженная пиелоэктазия (более 10 мм) свидетельствует о значительном затруднении оттока мочи из почки. Затруднение оттока мочи из почки может нарастать, вызывая сдавление, атрофию почечной ткани и снижение функции почки.
Кроме того, нарушение оттока мочи нередко сопровождается присоединением пиелонефрита – воспаления почки, ухудшающего ее состояние. Несколько чаще расширение лоханок почек выявляется у плодов с синдромом Дауна. Однако этот маркер относится к «малым» маркерам синдрома Дауна, поэтому выявление только расширения почечных лоханок не повышает риск наличия синдрома Дауна и не является показанием к проведению других диагностических процедур. Единственное, что нужно сделать до родов – пройти контрольное УЗИ в 32 недели и еще раз оценить размеры почечных лоханок.
Нужно ли обследовать ребенка после родов?
У многих детей умеренная пиелоэктазия исчезает самопроизвольно в результате дозревания органов мочевыделительной системы после рождения ребенка. При умеренной пиелоэктазии бывает достаточно проводить регулярные ультразвуковые исследования каждые три месяца после рождения ребенка. При присоединении мочевой инфекции может понадобиться применение антибиотиков. При увеличении степени пиелоэктазии необходимо более детальное урологическое обследование.
В случаях выраженной пиелоэктазии, если расширение лоханок прогрессирует, и происходит снижение функции почки, бывает показано хирургическое лечение. Хирургические операции позволяют устранить препятствие оттоку мочи. Часть оперативных вмешательств может с успехом выполняться эндоскопическими методами – без открытой операции, при помощи миниатюрных инструментов, вводимых через мочеиспускательный канал. В любом случае вопрос об оперативном лечении решается после рождения ребенка и полного его обследования.
Что делать при выявлении ультразвуковых маркеров хромосомной патологии у плода?
Вам следует обратиться к специалисту генетику, который еще раз оценит результаты ультразвукового исследования и биохимического скрининга, рассчитает риск индивидуально для вашего случая и даст необходимые рекомендации по дальнейшему ведению беременности.
© 2021 краевое государственное бюджетное учреждение здравоохранения «Красноярский краевой медико-генетический центр» (КГБУЗ «ККМГЦ»)
Если при ультразвуковом исследовании найден гиперэхогенный фокус в желудочке сердца
Что такое гиперэхогенный фокус в сердце у плода?
Гиперэхогенный фокус – это термин, говорящий о повышенной эхогенности (яркости) небольшого участка сердечной мышцы на ультразвуковом изображении. Выявление гиперэхогенного фокуса в сердце НЕ является пороком развития сердца, а просто отражает характер его ультразвукового изображения. Гиперэхогенный фокус возникает в месте повышенного отложения солей кальция на одной из мышц сердца, что не мешает нормальной работе сердца плода и не требует никакого лечения.
Почему у плода может выявляться гиперэхогенный фокус в сердце?
Возможные причины возникновения гиперэхогенного фокуса в сердце:
Что делать при выявлении гиперэхогенного фокуса в сердце плода?
При возникновении гиперэхогенного фокуса:
*Существует ряд пороков развития, которые могут быть выявлены только в третьем триместре беременности. Естественно, большинство пороков развития (пороки сердца, расщелины губы и неба, позвоночные грыжи, аномалии количества пальцев на кистях и стопах и многие другие) исключаются или диагностируются во втором триместре беременности.
В третьем триместре могут проявиться заболевания, связанные с неправильной работой некоторых органов и систем, которые изначально сформировались нормально.
В силу каких-то причин в организме человека на любом этапе жизни могут возникать определенные изменения. Иногда они возникают в пожилом или среднем возрасте, а иногда – уже во внутриутробном периоде. Именно эти особенности мы изучаем на скрининге в третьем триместре беременности: ищем признаки кишечной непроходимости, оцениваем работу почек, т.к. иногда у плода формируется нарушение оттока мочи из почек, приводящее к возникновению гидронефроза (повышенного скопления мочи в чашечно-лоханочной системе почек), исключаем кисты органов брюшной полости и яичников, убеждаемся в отсутствии новообразований (опухолей) плода.
Очень важно оценить развитие головного мозга, т.к. этот орган все еще продолжает формироваться, и иногда мы видим повышенное количество жидкости в желудочковой системе мозга (вентрикуломегалия и в тяжелых случаях гидроцефалия), которое мешает нормальному развитию ткани мозга. Иногда у плода формируются опухоли мозга или внутричерепные кровоизлияния, которые так же будут сдавливать и повреждать соседние ткани мозга.
Некоторые пациенты спрашивают: зачем выявлять пороки развития в 32-34 недели беременности, если все равно никаких действий до родов не будет сделано, ребенок уже жизнеспособен и вопрос о прерывании беременности уже не обсуждается.
Действительно, на этих сроках беременности показания к прерыванию беременности возникают лишь в исключительных случаях. Однако, информация о наличии у ребенка определенных особенностей и заболеваний может оказать существенную помощь неонатологам, детским хирургам, неврологам и нейрохирургам, т.к. после рождения иногда бывает дорога каждая минута жизни.
Наличие известного диагноза позволяет всем специалистам быть готовым к рождению такого ребенка и к оказанию неотложной помощи своевременно и в полном объеме, что существенно увеличивает шансы на выздоровление малыша.
Приятный бонус к 3 скринингу в Центре Медицины плода: всем пациентам мы вручаем сертификат на первое бесплатное посещение неонатолога. Воспользоваться подарком можно в течение полугода с момента рождения малыша.
Мы надеемся, что эта информация помогла Вам узнать, какое значение имеет скрининговое ультразвуковое исследование в третьем триместре беременности. Коллектив Центра медицины плода желает Вам здоровья, легкого течения беременности и рождения здорового малыша!
УЗИ при беременности в Центре медицины плода – высочайшая точность исследований и экспертная диагностика здоровья плода!
Все ультразвуковые обследования в центре проводятся по международным стандартам FMF (Fetal Medicine Foundation) и ISUOG (Международного общества ультразвука в акушерстве и гинекологии).
Врачи ультразвуковой диагностики имеют международные сертификаты Fetal Medicine Foundation (Фонд медицины плода, Великобритания), которые подтверждаются ежегодно.
Мы беремя за самые сложные случаи и, при необходимости, возможно проведение консультации со специалистами Госпиталя Королевского Колледжа, King’s College Hospital (Лондон, Великобритания).
Возможности этих приборов позволяют говорить о новом уровне информативности.
Записаться на прием
Записаться на прием и получить экспертное мнение наших специалистов ультразвуковой диагностики вы можете по телефону единого контакт центра +7 (812) 458-00-00