цитохимическое исследование костного мозга
Цитохимическое исследование костного мозга
Бласты при остром миелобластном лейкозе обычно крупные клетки с округлым или неправильной формы ядром. Патогномоничным морфологическим маркером острого миелобластного лейкоза является обнаружение в цитоплазме бластных клеток гранул или линейной азурофильной зернистости (палочек Ауэра).
Большинство форм острого миелобластного лейкоза, в отличие от острого лимфобластного лейкоза, может быть идентифицировано морфологически. Миелобласты делятся на типы в зависимости от числа и качества гранул (в бластах I типа нет гранул; бласты II типа содержат до 15 нежных гранул; в бластах III типа — множество азурофильных гранул).
Лимфобласты обычно мелкие, ядро более правильной формы, цитоплазма скудная и агранулярная.
Сущность цитохимических исследований заключается в выявлении в клетке ферментов и цитоплазматических включений, характерных для того или иного типа клетки. В процессе цитохимической реакции происходит взаимодействие находящегося в клетке фермента или иного вещества с реагентами рабочего раствора.
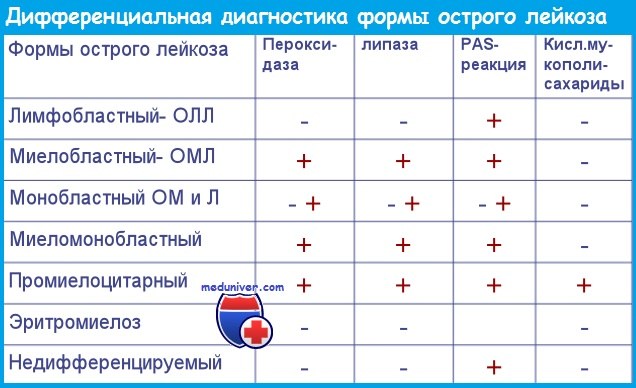
Основные цитохимические реакции, использующиеся для диагностики и дифференциальной диагностики острого лейкоза:
1) наиболее важно выявление миелопероксидазы (фермента азурофильных гранул клеток гранулоцитарного и моноцитарного рядов); эта реакция может быть положительной при отсутствии видимых гранул;
2) вторым по значимости является судан черный В; если одна из двух реакций положительна более чем в 3% бластов, это свидетельствует об их принадлежности к миелоидной линии;
3) неспецифическая эстераза типична для моноцитов и монобластов, но может выявляться при остром лимфобластном лейкозе и МЗ; эти реакции чувствительны к ингибированию фторидом натрия, что используется для дифференциальной диагностики;
4) положительная PAS-реакция свидетельствует о наличии в клетках гликогена и наиболее типична для острого эритромиелоза; гликоген выявляется также при остром лимфобластном лейкозе и других типах острого миелобластного лейкоза
5) нафтол AS-D хлорацетатэстераза обнаруживается в созревающих миелоидных клетках;
6) кислая фосфатаза выявляется при Т-ОЛЛ;
7) а-нафтолбутиратэстераза свидетельствует о моноцитарной дифференцировке клеток.
Для верификации варианта острого лейкоза используются и другие методы. Так, для диагностики М4 и М5 вариантов острого миелобластного лейкоза используется цитобактериальный тест на лизоцим.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Цитохимическое исследование костного мозга
Цитогенетический анализ клеток костного мозга (кариотип) – исследование, целью которого является оценка количества и структуры хромосом клеток кроветворной ткани.
Стандартное кариотипирование клеток костного мозга, стандартная цитогенетика в метафазных пластинках.
Chromosome Analysis, Bone Marrow, Karyotype, Cytogenetics, Cytogenetic Analysis, Chromosome Studies, Chromosome Karyotype.
Дифференциальное окрашивание хромосом.
Какой биоматериал можно использовать для исследования?
Общая информация об исследовании
Взятие костного мозга для исследования проводится посредством пункции кости. Манипуляцию выполняет врач. Чаще всего костный мозг аспирируется из грудины или задних остей подвздошных костей. После выбора места пункции и обработки кожи над ним раствором антисептика врач проводит послойную местную анестезию до надкостницы. После введения анестетика ждут наступления анестезии не менее одной минуты. Пункцию выполняют специальной иглой, которая имеет внутри стержень. Её продвигают сквозь мягкие ткани до надкостницы, затем с усилием внедряют вглубь костного вещества. После этого убирают стержень и шприцем набирают костный мозг. Во время аспирации возможно возникновение болевых ощущений из-за перепада давления в полости кости. Полученный костный мозг переливают в вакутейнер, содержащий гепарин натрия, и отправляют в лабораторию.
Большинство опухолей кроветворной системы связаны с возникновением генетических изменений в столовой клетке крови, которые приводят к её злокачественной трансформации и появлению опухолевого клона. Генетические нарушения специфичны для определенного заболевания, поэтому их обнаружение считается достоверным диагностическим критерием. Кроме того, наличие некоторых генетических аномалий может влиять на прогноз заболевания, его чувствительность к тем или иным способам лечения и, соответственно, помогает выбрать наилучшую тактику терапии. Стандартное цитогенетическое исследование клеток костного мозга представляет собой изучение количества и структуры хромосом клеток и позволяет выявить геномные (нарушения в количестве хромосом) и хромосомные (изменения в их структуре) мутации.
Хромосомы – структуры в ядре клетки, в которых компактно собрана генетическая информация в виде ДНК. Когда клетка находится в состоянии покоя, хромомосы упакованы в клеточном ядре и визуально различить их друг от друга невозможно. Однако в одну из фаз деления клетки, которая называется метафаза, хромосомы выстраиваются в одну плоскость в центре клетки, формируя так называемую метафазную пластинку. Именно такие метафазные пластинки и изучаются в процессе цитогенетического исследования. Кроветворные клетки костного мозга постоянно делятся, поэтому часть из них во время взятия как раз будет находиться в метафазе своего деления. Преимущество такого метода цитогенетического исследования в том, что оно не требует дополнительных воздействий на клетки для стимуляции деления и получения метафаз. После обработки биоматериала различными химическими веществами клетки фиксируют на предметных стеклах и производят окраску. Существует несколько методов окраски хромосом, каждый из которых позволяет лучше дифференцировать те или иные особенности их строения. Хромосомы анализируется как с помощью микроскопа, так и с использованием компьютерных аналитических систем, которые существенно повышают качество и скорость исследования.
Кариотипирование проводится как минимум на двадцати хорошо окрашенных, полных метафазных пластинках с хорошим разбросом хромосом. Исследователь подсчитывает их количество и проводит оценку структуры каждой путем сопоставления двух аналогичных хромосом и сравнения их с цитогенетическими картами.
Для чего используется исследование?
Когда назначается исследование?
Что означают результаты?
Нормальный кариотип человека выглядит следующим образом:
46,ХХ – нормальный кариотип женщины,
46,XY – нормальный кариотип мужчины,
Количество проанализированных метафаз, а также метафаз, в которых выявлены мутации, записывается в квадратных скобках. Для записи генетических аномалий существуют специальные правила, соответственно которым будет написан результат исследования при выявлении какой-либо мутации.
Количественные аномалии хромосом записываются как их общее число, перечисление половых хромосом и номер отсутствующей или лишней хромосомы с соответствующим знаком минус или плюс.
Для обозначения структурных аномалий используются специальные буквенные символы:
t – транслокация – участок одной хромосомы переносится на другую,
del – делеция – потеря участка хромосомы,
inv – инверсия – поворот участка хромосомы на 180 градусов,
— после которых указывается номер хромосомы, на которой они обнаружены, а также ее участок.
В заключении цитогенетического исследования содержится информация о виде мутации и доле метафазных пластинок, в которой она выявлена.
Что может влиять на результат?
Кто назначает исследование?
Методы цитохимического и иммуноцитологического исследования клеток крови и кроветворных органов
Международные названия
Содержание
Лабораторная диагностика онкогематологических заболеваний основывается на изучении мазков периферической крови и костного мозга, окрашенных по Паппенгейму (Маю — Грюнвальду — Романовскому — Гимзе). Для уточненного выделения отдельных форм и цитологических вариантов острых лейкозов, наряду с учетом цитоморфологических признаков лейкозно трансформированных клеток, используются результаты цитохимических, иммуноцитологических, молекулярно-генетических исследований [1–3].
Цитохимические методы
Выявление активности миелопероксидазы методом Loele (1936) [4, 5]
Выявление липидов окраской суданом черным В по Ackerman (1952) [5]
Выявление активности щелочной фосфатазы методом одновременного азосочетания по Kaplow (1955) [5, 12]
Результат. В цитоплазме клеток, обладающих активностью ЩФ, обнаруживаются гранулы синего цвета. Активность ЩФ, выраженная в различной степени, определяется в нейтрофильных метамиелоцитах, палочкоядерных и сегментоядерных нейтрофилах, остеобластах, клетках эндотелия сосудов и синусов костного мозга [5, 6, 8].
Кислая фосфатаза. Цитохимическое выявление активности кислой фосфатазы (фосфогидролазы моноэфиров ортофосфорной кислоты, КФ 3.1.3.2) также производится с помощью метода одновременного азосочетания. Для связывания освобождающихся под действием фермента замещенных нафтолов чаще используется гексаазотированный парарозанилин.
Определение активности кислой фосфатазы методом одновременного азосочетания по Goldberg, Barka (1962) [5, 13]
1. Фиксация свежеприготовленных и высушенных на воздухе мазков крови, костного мозга и отпечатков лимфатических узлов в парах 10% раствора нейтрального формалина в течение 3 мин.
2. Инкубация мазков в течение 3 ч при 37 °С в свежеприготовленной и профильтрованной смеси следующего состава:
Гексаазотированный парарозанилин предварительно получают в пробирке при смешивании 4 капель 4% раствора нитрита натрия и 4% раствора парарозанилина. Пробирки встряхивают в течение 30 с. О произошедшем гексаазотировании свидетельствует легкое запотевание стенок пробирки и изменение цвета раствора, становящегося янтарно-желтым. Для получения раствора парарозанилина, который может храниться в холодильнике при температуре 4 °С в течение 7–10 дней, 1 г фуксина основного для фуксинсернистой кислоты растворяют в 25 мл 2 н. соляной кислоты при подогревании, охлаждают и фильтруют.
0,05 М ацетатный буфер готовят путем соответствующего разведения 0,2 М раствора (см. ниже).
3. Промывание мазков в воде, высушивание и микроскопирование.
Результат. Активность КФ определяется в виде гомогенной окраски или мелких гранул красного цвета в цитоплазме клеток. В Т-лимфоцитах и Т-лимфобластах наблюдается окрашивание в виде крупных гранул или пятна в одном участке цитоплазмы.
При добавлении в инкубационную среду ингибитора КФ — калиево-натриевой соли виннокаменной (L тартаровой) кислоты в концентрации 0,005 М (352 мг на 25 мл инкубационной смеси) активность фермента в клетках сохраняется только при волосатоклеточном лейкозе и В-пролимфоцитарном лейкозе [5, 8].
Выявление активности неспецифической эстеразы реакцией одновременного азосочетания по Pearse (1960) в модификации Loffler (1961) [14]
1. Фиксация мазков крови и отпечатков кроветворных органов в парах 10% раствора формалина в течение 3 мин.
2. Обезжиривание в эфире в течение 20 с.
3. Нанесение на мазки на 1 ч при комнатной температуре профильтрованной смеси следующего состава:
4. Промывание мазков, высушивание и микроскопирование.
Результат. В участках ферментативной активности в цитоплазме клеток выявляются гранулы красного цвета.
Контрольные мазки инкубируют в среде, из которой исключен субстрат, а также в смеси, к которой добавляется фторид натрия из расчета 1,5 мг на 1 мл раствора.
Выявление активности кислой a‑нафтилацетатэстеразы методом одновременного азосочетания по Mueller и соавторов [16]
1. Фиксация свежеприготовленных и высушенных на воздухе мазков крови, костного мозга и отпечатков лимфатических узлов в парах 10% раствора нейтрального формалина в течение 3 мин.
2. Инкубация мазков в течение 3 ч при комнатной температуре в смеси следующего состава:
Результат. В участках ферментативной активности в цитоплазме клеток обнаруживается конечный продукт реакции красно-коричневого цвета.
Хлорацетатэстераза. При применении в качестве субстрата нафтол-AS-D-хлорацетата в клетках обнаруживается активность фермента, условно называемого ХАЭ. Последний является маркером нейтрофильных лейкоцитов различной степени зрелости и тучных клеток.
Выявление активности хлорацетатэстеразы методом одновременного азосочетания по Moloney, McPherson, Fliegelman (1960) [17]
1. Фиксация свежеприготовленных и высушенных на воздухе мазков крови, костного мозга и отпечатков лимфатических узлов в парах 10% раствора нейтрального формалина в течение 3 мин.
2. Инкубация мазков в течение 1,5 ч при комнатной температуре в смеси следующего состава:
3. Промывание мазков в воде и высушивание.
Результат. Активность ХАЭ определяется в виде гранул синего цвета в цитоплазме клеток.
Контрольные мазки инкубируются в среде, из которой исключен субстрат реакции, или в смеси, в которой нафтол-AS-D-хлорацетат заменен эфирами уксусной кислоты и других замещенных нафтолов.
Выявление b-глюкуронидазы методом одновременного азосочетания по Hayashi и соавторов [19] и Lorbacher и соавторов (1967) [4]
1. Фиксация свежеприготовленных и высушенных на воздухе мазков крови, костного мозга и отпечатков лимфатических узлов в парах 10% раствора нейтрального формалина в течение 3 мин.
2. Инкубация мазков при 37 °С в течение 60 мин в смеси следующего состава:
Довести рН раствора до 5,2–5,4 с помощью 1 н. NaOH, добавить дистиллированную воду до конечного объема 20 мл.
PAS-реакция. В качестве методической основы для цитохимического выявления гликогена в клетках крови, костного мозга и лимфатических узлов применяется так называемая PAS-, или ШИК-реакция, в сокращенном наименовании которой отражено название реактивов, с помощью которых выявляется внутриклеточная локализация полисахарида (Periodic Acid-Schiff reaction или реакция с реактивом Шиффа — йодной кислотой). Окрашенный продукт реакции образуется в результате взаимодействия реактива Шиффа с диальдегидом, возникающим при разрыве С-С-связей в структурах, содержащих две смежные гликолевые группы в положении 1,2 (СНОН-СНОН), окисляющиеся под влиянием перйодной кислоты.
Выявление гликогена с помощью PAS‑реакции по McManus (1956) и Hotchkiss (1948) [5]
1. Фиксация свежеприготовленных и высушенных на воздухе мазков крови, костного мозга и отпечатков лимфатических узлов в парах 10% раствора нейтрального формалина в течение 3 мин.
2. Погружение мазков на 10 мин в 1% раствор перйодной кислоты.
3. Промывание в дистиллированной воде и высушивание.
4. Помещение препаратов в реактив Шиффа на 30 мин при комнатной температуре в темноте.
Приготовление реактива Шиффа:
Вариант I. 1 г фуксина заливают 200 мл кипящей дистиллированной воды и охлаждают до 50 °С, фильтруют и добавляют 40 мл 1 н. соляной кислоты; охлаждают до 25 °С и добавляют 2 г метабисульфита натрия или калия. Раствор хранят в холодильнике.
Вариант II. 1 г фуксина растворяют при осторожном помешивании в 200 мл дважды кипящей дистиллированной воды, поддерживая слабое кипение раствора в течение 5 мин, охлаждают до 18–20 °С, добавляют 2 г метабисульфита натрия или калия и интенсивно встряхивают смесь в течение 3 мин, добавляют 20 мл соляной кислоты, закрывают герметично пробкой и оставляют в темноте при 4–6 °С. В течение 6–12 ч раствор обесцвечивается.
Качество основного фуксина является решающим: необходимо пользоваться только высокоочищенными марками реактива с пометкой «фуксин основной для фуксинсернистой кислоты».
5. Промывание мазков в проточной воде в течение 20 мин и высушивание.
Результат. В местах локализации PAS-положительных веществ в цитоплазме клеток наблюдается диффузное или гранулярное пурпурно-красное окрашивание.
Иммуноцитологические методы
Основная задача, решаемая при помощи иммуноцитологических методов в современной онкогематологии, — определение спектра антигенов поверхностных мембран, цитоплазмы и ядер клеток, относящихся к патологическому клону, т.е. их иммунофенотипа. Главное условие для успешного выполнения этой задачи — правильный подбор моноклональных антител (мкАТ) в диагностическую панель, которая бы позволила при минимальных затратах точно определить гистогенез и степень дифференцированности тестируемых клеток, а также выбор адекватного иммуноцитохимического метода с учетом специфики исследуемого материала. В настоящее время известно около 200 кластеров дифференцировочных, линейных, активационных антигенов и еще больше мкАТ для их распознавания [20]. В соответствующих разделах руководства достаточно полно освещены вопросы, касающиеся известных к настоящему времени иммунофенотипических признаков клеток различного генеза, которые составляют опухолевый субстрат при лейкозах, лимфомах и других опухолевых заболеваниях. В данном разделе мы подробнее рассмотрим различные иммуноцитохимические методы и способы их применения.
По способу связывания с тканевым антигеном различают прямые, непрямые и «сэндвич» методы. К числу последних принадлежат известные РАР (peroxidase-anti-peroxidase) [20–23] и АРААР (alkaline phosphatase-anti-alkaline phosphatase) методы (в русской интерпретации ПАП и ЩФАЩФ) [24–26]. На заключительном этапе иммунологической реакции в них используются комплексы, состоящие из мкАТ к ферменту и самого фермента (иммунный комплекс МПО — мкАТ к пероксидазе в ПАП-методе или ЩФ — мкАТ к ЩФ в ЩФАЩФ-методе). Несколько отличается по принципу связывания тканевого антигена с антителом, несущим ферментную метку, авидин-биотиновый метод (АВС или АБК), в котором используется «мостик» из меченных биотином антимышиных антител и авидина, соединенного с ферментом [27, 28]. Метод основан на высоком химическом сродстве гликопротеина яичного белка авидина к низкомолекулярному витамину из яичного желтка — биотину и отличается большой чувствительностью. В процессе иммуноцитохимической реакции образуется прочный авидин-биотиновый комплекс, несущий достаточное для его визуализации количество метки-фермента.
Принципы прямого и непрямого вариантов иммуноцитохимических методов соответствуют аналогичным вариантам иммунофлуоресцентного метода, за исключением того, что на завершающем этапе для проявления ферментной метки нужно проводить энзимогистохимическую реакцию [29, 30].
При прямом методе используют мкАТ или моноспецифические сыворотки, меченные ферментом. Иммунологическую реакцию связывания антител с клеточными антигенами, а затем и цитохимическую реакцию определения активности фермента, как правило, проводят в суспензии клеток, и цитологические препараты готовят из уже окрашенных клеток. Это наиболее простой метод, однако в иммуноцитохимии практически не применяется, поскольку имеет ряд недостатков. Прежде всего — это необходимость получения для каждого определяемого антигена конъюгированных с ферментом антител, а также недостаточно интенсивное мечение хорошо распластанных клеток в цитологических препаратах. Кроме того, инкубирование суспензии клеток с антителами часто приводит к смещению антигенов к одному из полюсов клетки с образованием «кэп’ов» («шапочек»), а иногда и к их слущиванию при последующих процедурах отмывания клеток [26]. Прямой метод с использованием мкАТ, меченных флуоресцентными красителями, с успехом применяют в проточной цитофлуориметрии.
Непрямой метод иммуноцитохимического анализа лишен многих недостатков прямого метода. Его проводят в два этапа: на первом происходит связывание немеченых мкАТ с искомым антигеном, а для выявления этой связи на втором этапе используют антитела, конъюгированные с ферментом. При этом антитела второго слоя должны быть специфичны к иммуноглобулинам того вида животных, от которых получены первые антитела. Поскольку в настоящее время в основном используют мкАТ, получаемые от мышей, соответственно антитела второго слоя должны быть направлены против иммуноглобулинов мыши. В непрямом варианте иммуноферментного метода с каждой молекулой антител связываются две молекулы меченых антител второго слоя. Таким образом, при одном и том же количестве антигена в местах связывания обнаруживается большее количество интенсивно окрашенных конечных продуктов ферментативной реакции [20, 29, 30]. Этот метод более чувствительный, чем прямой, и достаточно широко применяется, в частности, в технике ELISA для идентификации антител в сыворотке крови пациентов с различными инфекционными и неинфекционными заболеваниями. Однако он мало подходит для выявления «слабых» антигенов и антигенов, представленных на поверхностной мембране клетки в небольших количествах. Для усиления специфического окрашивания мест связывания антигена на поверхности клетки при непрямом иммунопероксидазном методе предложены различные способы: введение на заключительном этапе реакции в раствор хромогенного субстрата солей тяжелых металлов, в частности осмия, или проведение повторной инкубации препаратов с мечеными антителами, но направленными против иммуноглобулинов животных, от которых получена вторая сыворотка. Непрямой метод в настоящее время редко применяется для иммунофенотипирования лейкоцитов, значительно шире используются «сэндвич»-методы (ПАП и ЩФАЩФ) и авидин-биотиновые (АВС) методы исследования.
Процедура иммуноцитохимических ПАП- и ЩФАЩФ-методов предусматривает выполнение трех последовательных этапов: инкубацию с мкАТ (мышиные иммуноглобулины) на первом этапе, с антисывороткой против иммуноглобулинов мыши на втором и с комплексом, состоящим из мышиных мкАТ к ферменту (МПО в ПАП-комплексе и ЩФ в ЩФАЩФ-комплексе) и самого фермента, — на третьем этапе. При этом антитела против иммуноглобулинов мыши (сыворотка второго этапа) берут в избыточном количестве для увеличения свободных мест связывания с иммуноглобулинами мыши первого и третьего этапов. Завершает процедуру цитохимическая реакция определения активности фермента, входящего в состав комплекса — МПО в ПАП-варианте или ЩФ в ЩФАЩФ-варианте иммуноцитохимического «сэндвич»-метода.
Использование мкАТ ПАП- или ЩФАЩФ-комплексов на несколько порядков повышает чувствительность иммуноцитохимических методов по сравнению с традиционным иммунофлуоресцентным. В составе стабильного циклического комплекса на две молекулы антитела приходится три молекулы фермента и, поскольку они связаны не химически, а как антиген с антителом, не утрачивается способность связываться с антителами второго слоя через F(ab’)2-фрагменты Ig и не ингибируется активность фермента. Таким образом, создается повышенная концентрация ферментной метки в местах связывания первичного (моноклонального) антитела с выявляемым антигеном и становится возможным обнаружение антигенных структур, плотность которых на поверхностной мембране клетки недостаточно велика. Это позволяет использовать антитела в высоких разведениях и добиться уменьшения неспецифического окрашивания. При необходимости интенсивность специфического окрашивания можно усилить, повторяя второй и третий этапы иммунологической реакции до начала цитохимической реакции [31, 32].
Метод с использованием авидин-биотинового комплекса (АВС) не уступает ПАП- и ЩФАЩФ-методу по чувствительности и интенсивности окрашивания мест специфического связывания тканевого антигена с мкАТ к нему. Технически процедура его выполнения аналогична описанной выше для ПАП- и ЩФАЩФ-методов с той лишь разницей, что на втором этапе реакции используются антитела к иммуноглобулинам мыши, конъюгированные с биотином, а на третьем — авидин, меченный ферментом (МПО или ЩФ) [27, 28].
Характерной особенностью третичной структуры молекулы авидина (гликопротеин с мол. массой 68 кД) является наличие четырех гидрофобных «впадин», которые служат местом специфического связывания молекул биотина — водорастворимого витамина Н, содержащегося в яичном желтке и других тканях (печени, почках, кишечнике, поджелудочной железе). Благодаря высокой степени сродства биотина к авидину любое вещество, конъюгированное с биотином, можно обнаружить по его взаимодействию с авидином. При биотинилировании иммуноглобулинов или их F(ab’)2-фрагментов происходит связывание карбоксильной группы биотина с NH2-группами белка, при этом биологические свойства конъюгированного компонента полностью сохраняются
К недостаткам АВС-метода можно отнести возможность связывания авидина с эндогенным биотином при исследовании некоторых органов и тканей (почками, печенью), а также окрашивание гранул тучных клеток, связывающих авидин, что приводит к ложноположительным результатам иммуноцитохимической реакции. Однако этот недостаток легко устраняется, если использовать вместо авидина его аналог — стрептавидин (белок с мол. массой 60 кД, полученный из Streptomyces avidinii). Подобно авидину он также является тетрамером, состоящим из четырех идентичных субъединиц, каждая из которых содержит высокоаффинные сайты связывания биотина. В отличие от авидина в нем нет олигосахаридных остатков, которые могут взаимодействовать с пектиноподобными белками клеток и тканей и обусловливать неспецифическое окрашивание. Кроме того, изоэлектрическая точка авидина 10,5, а стрептавидина близка к нейтральной, что исключает неспецифическое связывание стрептавидина с цитоплазматическими или ядерными мембранами клеток при рН 7,4, который поддерживается на всех этапах проведения иммуноцитохимической реакции [27–30, 32].
Как уже отмечалось выше, выбор фермента — метки антител во многом зависит от типа ткани (клеток), в которой предстоит проводить иммуноцитохимическую реакцию. Иммунные комплексы с МПО являются оптимальными для работы с отмытыми клетками лимфатических узлов, определения субпопуляций лимфоцитов крови, изучения иммунофенотипа клеток при лимфоидных формах лейкозов [23]. Однако для работы с мазками крови и костного мозга, для определения иммунофенотипа клеток миелоидного генеза, в том числе при острых лейкозах, когда клетки лишены признаков линейной принадлежности либо содержат эндогенную МПО в качестве метки антител третьего слоя, предпочтительнее использовать ЩФ. Для этих целей больше подходит ЩФАЩФ-метод и комплекс авидин — ЩФ, вместо комплекса авидин — МПО [25, 33, 34].
Применение ЩФ в качестве метки антител началось с непрямого иммуноферментного метода для выявления двух разных антигенов в одном образце гемопоэтической ткани [35], причем один из антигенов метился с помощью ПАП-комплекса, а другой — конъюгатом антимышиных иммуноглобулинов со ЩФ. Продукт цитохимической реакции определения активности ЩФ может быть красным или синим в зависимости от используемого в субстратной смеси красителя, что позволяет получить хороший контраст с коричневым продуктом иммунопероксидазной реакции. Оптимальный уровень рН для выявления активности ЩФ из кишечника теленка, которая обычно используется в качестве метки антител, находится в пределах 7,6–8,0. При этих значениях рН наиболее эффективен левамизол, применяемый в качестве ингибитора эндогенной ЩФ гранулоцитов крови. При более низких значениях рН обнаруживается эндогенная фосфатазная активность в макрофагах, не ингибируемая левамизолом [24, 26, 36].
Преимущества, которые получает исследователь, анализируя антигенную структуру клеток непосредственно в мазках периферической крови, костного мозга, лейкоконцентратов венозной крови, экссудатов из серозных полостей, очевидны. Помимо возможности изучения иммунофенотипа клеток, можно определить их морфологические признаки или обнаружить редкие антигенположительные клетки, несвойственные данному типу ткани (например, раковые клетки в мазках костного мозга или лимфатических узлов).
Подготовка цитологических препаратов для проведения иммунофенотипирования, условия их хранения и фиксации — важные моменты для успешного проведения иммуноцитохимической реакции [26, 32, 34, 37]. Ниже мы подробно опишем технику приготовления цитологических препаратов типа «высушенных капель» из суспензии отмытых клеток крови, костного мозга, лимфатических узлов и других тканей, а также условия для успешного проведения иммуноцитохимических исследований.
Цитологические препараты
Мазки из клеток цельной крови или костного мозга готовят обычным способом при помощи распределительного стекла на тонких, хорошо обезжиренных предметных стеклах. Мазки должны быть достаточно тонкими и высушенными на воздухе в течение не менее 1 ч при комнатной температуре.
Цитологические препараты в виде высушенных капель готовят из суспензии клеток, выделенных в градиенте плотности фиколл-верографина (плотность 1,076–1,078) из гепаринизированной венозной крови или костного мозга и отмытых в забуференном изотоническом растворе (ЗИР) натрия хлорида (рН 7,2–7,4). В очерченные на предметных стеклах участки вносят по 25–30 мкл суспензии клеток в концентрации 2–4 млн/мл, выдерживают 20 мин в строго горизонтальном положении во влажной камере при комнатной температуре (18–22 °С), затем аккуратно сливают излишки раствора на фильтровальную бумагу и быстро высушивают образовавшийся слой клеток при помощи вентилятора [32].
Хранение
Антигенные свойства клеток в препаратах сохраняются в неизменном виде, если нефиксированные цитологические препараты в виде высушенных капель хранятся завернутыми в фильтровальную бумагу не более 1 нед при температуре 4 °С, а в виде мазков — несколько месяцев при температуре –20 °С завернутыми в тонкую алюминиевую фольгу.
Фиксация
Цитологические препараты из отмытых клеток, завернутые в фильтровальную бумагу, достают из холодильника в день проведения иммуноцитохимической реакции и доводят до комнатной температуры в течение 20–30 мин, не разворачивая. Когда мазки достаточно согрелись, их вынимают из бумаги и помещают на 5 мин в камеру для фиксации, наполненную парами 10% раствора формалина (100% раствор формалина разводят 1:10 дистиллированной водой и пропитывают им несколько слоев фильтровальной бумаги, которую затем укладывают на дно герметично закрывающейся камеры; через несколько минут в камеру с парами формалина можно помещать препараты для фиксации).
Мазки из цельной крови или костного мозга фиксируют в растворе забуференного формол-ацетона [26], который готовят следующим образом: 128 мг NaH2PO4.2H2O и 12 мг Na2HPO4.12H2O растворяют в 30 мл дистиллированной воды, добавляют 45 мл химически чистого ацетона и 25 мл 40% раствора нейтрального формальдегида. Доводят смесь до рН 6,6 под контролем рН-метра концентрированным раствором NaOH (смесь хранят при 4 °С в посуде с притертой пробкой не больше 1 мес). Мазки вынимают из морозильной камеры непосредственно перед фиксацией, освобождают от алюминиевой фольги и немедленно заливают фиксатором на 40 с, после чего фиксатор сливают, а мазки сразу погружают в отмывающий раствор, состоящий из 94 мл 0,9% раствора NaCl и 6 мл 0,1 М фосфатного буфера (рН 7,2–7,4). Этот ЗИР используется и на других этапах иммуногистохимической реакции, поэтому его готовят в количестве не менее 200–300 мл в день проведения иммунофенотипирования или накануне и хранят в холодильнике.
Мазки вынимают из ЗИР, очерчивают на них участки, куда затем будут наносить антитела, подписывают их, а участок вокруг просушивают фильтровальной бумагой. Участок на стекле, где будет проходить иммуноцитохимическая реакция, должен оставаться влажным на протяжении всех циклов инкубации с антителами, но без лишней жидкости, чтобы не допустить переразведения наносимых на этот участок специфических антисывороток и мкАТ.
Техника проведения иммуноцитохимических методов
Перечислим основные правила, которые необходимо соблюдать при выполнении иммуноцитохимических реакций:
Непрямой иммуноцитохимический метод чаще используют при работе с отмытыми клетками (препараты типа «высушенной капли»), процедура проведения следующая:
1. Согретые до комнатной температуры предметные стекла с нанесенными на них клетками фиксируют в течение 5 мин в парах формалина, укладывают горизонтально в специально подготовленный бокс (влажную камеру) и наносят моноспецифические сыворотки или мкАТ в рабочем разведении на очерченные участки. Инкубируют 1 ч при комнатной температуре.
2. Аккуратно стряхивают антитела первого слоя на фильтровальную бумагу и промывают стекла, слегка покачивая, поочередно в двух стаканчиках с ЗИР. Просушивают фильтровальной бумагой участки стекла вокруг очерченной зоны, не задевая ее, и наносят антитела второго слоя — специфические антитела против иммуноглобулинов мыши, меченные МПО или ЩФ. Если на первом этапе реакции использовали кроличью моноспецифическую сыворотку, а не мышиные мкАТ, то на втором следует применять антитела козы или осла против иммуноглобулинов кролика, меченные ферментом. Продолжительность второго этапа инкубации — 1 ч.
3. Стряхивают антитела второго слоя, промывают и просушивают стекла, как описано выше. Выполняют цитохимическую реакцию определения активности фермента, который использовался в качестве метки антител. Для этого наносят на отмеченные участки раствор, содержащий хромогенный субстрат, инкубируют 10–20 мин, смывают дистиллированной водой, докрашивают ядра клеток в течение 1 мин 0,1% раствором метилового зеленого, снова промывают стекла в воде и высушивают на воздухе. Анализируют в иммерсионной системе светооптического микроскопа. При использовании в качестве метки антител МПО, а в качестве хромогенного субстрата 3,3’-диаминобензидина (ДАБ) в антиген-положительных клетках будет наблюдаться темно-коричневое окрашивание. Если меткой антител служила ЩФ, цвет продукта цитохимической реакции будет зависеть от выбранного красителя: при использовании прочного синего PP конечный продукт реакции будет темно-синим, прочного красного TR и гексаазотированного парарозанилина — красным.
ПАП, ЩФАЩФ и авидин-биотиновый методы, которые обладают более высокой чувствительностью, лучше подходят для выявления антигенной структуры клеток в мазках и цитоцентрифужных препаратах. При использовании ПАП-метода для работы с мазками крови и костного мозга существует необходимость в предварительной обработке мазков с целью ингибирования активности эндогенной МПО и неспецифического окрашивания эритроцитов раствором, содержащим ДАБ [38]. При изучении иммунофенотипических особенностей бластных клеток при острых лейкозах мы отдаем предпочтение методам с использованием ЩФ в качестве метки антител — ЩФАЩФ и АВС [32, 39]. Техника выполнения всех трех методов (ПАП, ЩФАЩФ И АВС) совпадает, за исключением завершающей процедуры — цитохимического определения активности фермента — метки антител последнего этапа. Рассмотрим подробнее эту процедуру.
1. Цитологические препараты после фиксации помещают в горизонтальном положении во влажную камеру и наносят 20–50 мкл мкАТ в отмеченные участки. Инкубировать в течение 1 ч при комнатной температуре (18–22 °С).
2. Осторожно стряхивают антитела первого этапа и промывают стекла в ЗИР (меняя его 3 раза), просушивают свободные от клеток участки стекла, стараясь не задеть отмеченные зоны реакции. Наносят 20–50 мкл немеченой (при выполнении ПАП и ЩФАЩФ) кроличьей (козьей, ослиной) сыворотки против иммуноглобулинов мышей (связующая сыворотка) в избыточном титре. При выполнении АВС-метода на этом этапе используют сыворотку против иммуноглобулинов мышей, конъюгированную с биотином. Инкубируют 30 мин.
3. Стряхивают антитела второго этапа, отмывают препараты свежим ЗИР (2–3 раза меняя его), удаляют фильтровальной бумагой излишек влаги со стекол и наносят в зоны реакции по 20–50 мкл сыворотки третьего этапа:
Инкубируют 1 ч во влажной камере при комнатной температуре.
4. Отмывают препараты, как описано выше, проводят цитохимическую реакцию определения активности:
Ядра клеток докрашивают метиловым зеленым или гематоксилином Майера, высушивают на воздухе, при необходимости заключают в глицерин, микроскопируют в иммерсионной светооптической системе.
Цитохимические методы определения активности ферментов в составе иммунных комплексов
Определение активности пероксидазы из хрена
1. Модифицированный метод Graham, Karnovsky (1966) с использованием ДАБ (3,3’-диаминобензидина солянокислого) [32]
Состав инкубационной смеси:
Инкубируют препараты 10 мин в свежеприготовленной смеси, промывают дистиллированной водой, докрашивают ядра 0,1% водным раствором метилового зеленого (1–2 мин) или гематоксилином Майера. Снова промывают препараты водой и высушивают. Продукт реакции коричневого цвета определяется в местах локализации антигена. В спиртах не растворяется.
2. Метод с использованием 3-амино-9-этилкарбазола (Graham, 1965) [32]
Состав инкубационной смеси:
Препараты инкубируют 10 мин при комнатной температуре, смывают дистиллированной водой и докрашивают клетки 0,1% водным раствором метилового зеленого. Продукт реакции красного цвета, растворим в спиртах.
3. Метод с использованием 4-хлор-1-нафтола (Nakane, 1968) [32]
Состав инкубационной смеси:
Инкубируют препараты при комнатной температуре 10 мин, промывают дистиллированной водой, докрашивают ядра нейтральным красным или кармалем. Продукт реакции темно-синего цвета, растворим в спиртах.
Способы ингибирования эндогенной миелопероксидазы
1 способ. Препараты фиксируют в свежеприготовленной смеси, состоящей из 200 мл абсолютного метанола и 50 мл 32% раствора перекиси водорода. Отмывают стекла в ЗИР (3 раза меняя его) в течение 10 мин. Процедуру проводят вместо предложенных выше способов фиксации до начала иммуноцитохимической реакции. Хорошо сохраняется морфология клеток, однако не все антигенные детерминанты остаются неизменными при жесткой фиксации в метаноле.
2 способ. Зафиксированные в парах формалина или в формол-ацетоне препараты последовательно обрабатывают 0,01% водным раствором перйодной кислоты и 0,1% водным раствором борогидрата натрия (по 10 мин при комнатной температуре). Затем препараты промывают дистиллированной водой и погружают на 10 мин в отмывающий раствор (ЗИР) до начала иммуноцитохимической реакции. Способ эффективно снижает активность эндогенной МПО в нейтрофильных лейкоцитах и практически не изменяет ее в эозинофилах.
3 способ. Зафиксированные препараты в течение 10 мин инкубируют в растворе, содержащем 0,3% Н2О2 в 0,1% растворе азида натрия (NaN3). Затем ингибитор сливают, отмывают препараты в ЗИР (3 раза меняя его) перед началом иммуноцитохимической реакции. Относительно мягкий и эффективный способ, позволяющий без ущерба для морфологических и антигенных свойств клетки снижать активность эндогенной МПО в большинстве клеток гранулоцитарного ростка кроветворения.
Определение активности щелочной фосфатазы из кишечника теленка
1. Реакция азосочетания с использованием прочного красного TR
Состав инкубационной смеси:
Вначале растворяют нафтол-AS-MX-фосфат в нескольких каплях ацетона или диметилформамида и сразу заливают нужным количеством трис-буфера. При необходимости ингибирования активности эндогенной ЩФ добавляют левамизол. Этот раствор достаточно стабилен и может храниться при температуре 4 °С несколько недель. Прочный красный вносят в раствор субстрата непосредственно перед использованием реактива.
Инкубируют препараты 20 мин при комнатной температуре. Раствор хромогенного субстрата смывают дистиллированной водой, докрашивают ядра клеток 0,1% водным раствором метилового зеленого 1–2 мин, смывают краситель водой и высушивают препараты на воздухе. Продукт реакции красного цвета, растворим в спиртах.
2. Реакция с использованием нового фуксина (гексаазотированного парарозанилина)
Состав инкубационной смеси:
Растворяют нафтол-AS-BI-фосфат в нескольких каплях ацетона или диметилформамида, добавляют трис-буфер и левамизол. Этот раствор достаточно стабилен и может храниться при температуре 4 °С несколько недель. Отдельно смешивают свежеприготовленный 4% NaNO2 и 5% новый фуксин, встряхивают 20–30 с для получения гексаазотированного парарозанилина. Непосредственно перед употреблением добавляют 75 мкл парарозанилина к раствору субстрата, смесь тщательно перемешивают и наносят на стекла на 20 мин. Затем инкубационную смесь смывают дистиллированной водой, докрашивают ядра клеток метиловым зеленым, снова промывают препараты и высушивают их на воздухе. Продукт реакции красно-малинового цвета, растворим в спиртах.