удаление метастазы в головном мозге
Удаление метастазы в головном мозге
Метастазы являются наиболее частыми внутричерепными опухолями. С улучшением контролирования системного заболевания все больше пациентов доживает до развития внутричерепных метастазов. Вследствие отсутствия лимфатической системы метастазы головного мозга имеют только гематогенную природу. Предполагается, что для метастазирования в мозг опухоли необходим определенный набор адгезивных клеточных молекул.
Не все первичные опухоли в равной степени способны к распространению в головной мозг. Меланома, рак бронхов, молочной железы, почки, толстой кишки легко метастазируют в головной мозг, в отличие от рака желудка и рака предстательной железы.
Метастазы могут быть единичными (только один выявленный метастаз в организме) или одиночными (только один выявленный метастаз в головном мозге). Может иметь место множественное поражение. При равном размере предполагается один случай метастатического процесса (синхронное метастазирование), при разнице размеров речь идет о метахронных метастазах.
а) Эпидемиология. В связи с ростом заболеваемости раком, старением населения и повышением эффективности системной терапии частота метастазов в головной мозг растет. Считается, что метастазы в мозг встречаются в десять раз чаще, чем первичные опухоли головного мозга. Для Европейского Союза годовая частота оценивается примерно 1 случай на 300000 населения.
б) Симптомы метастазов в головной мозга. Метастазы проявляются широким спектром симптомов. В зависимости от расположения они вызывают судороги (височнобазальные, перироландовые), очаговые неврологические дефициты, симптомы окклюзионной гидроцефалии, зрительные нарушения или поведенческие расстройства (чаще лобная локализация). Многие метастазы протекают бессимптомно. Двадцать процентов метастазов выявляются без известного первичного очага, и представление о том, где искать первичную опухоль часто складывается после гистологической оценки метастазов.
в) Осложнения. Кровоизлияние в большие метастазы может иметь те же симптомы, что и спонтанное внутримозговое кровоизлияние с внезапным неврологическим дефицитом, потерей сознания и даже развитием дислокационного синдрома. Кровоизлияния не патогномоничны для какого-либо гистологического типа опухолей.
Распространение клеток метастазов с их поверхности по ликворопроводящим путям может привести к вторичному метастазированию в пределах ЦНС и менингеальному карциноматозу.
Обширные метастазы могут привести к повышению концентрации белка в спинномозговой жидкости и арезорбтивной гидроцефалии.
г) Диагностика. Одним из основных компонентов диагностических процедур является нейровизуализация. Метастазы могут показывать повышение сигнала различной интенсивности, а при централизованном некротическом компоненте имитировать глиобластомы. Разнородность структуры — характерный показатель для метастазов. Обязательным исследованием на сегодня является МРТ, в частности, для получения информации о степени заболевания, которое может быть уже неизлечимым на момент постановки диагноза при выявлении десятка или более очагов.
С помощью КТ также можно выявить метастазы, однако этот метод уступает МРТ при обследовании инфратенториальной области и ствола мозга.
При наличии известного первичного очага в анамнезе легче заподозрить метастатическое поражение. Чаще всего диагноз ставится при исследовании ткани, полученной стереотаксической биопсией или при резекции.
д) Лечение метастазов в головной мозг. При планировании лечения в целом необходимо принимать во внимание общее состояние пациента, варианты лечения или контроля лежащего в основе заболевания, ожидаемую продолжительность жизни, в том числе качество жизни.
1. Консервативное лечение. Химиотерапия играет лишь ограниченную, но постепенно возрастающую роль в лечении метастазов головного мозга. В основном химиотерапии поддаются мелкоклеточный рак легких и некоторые метастазы рака молочной железы. При нерезектабельных случаях проводится облучение всего мозга с химиотерапией или без нее.
2. Хирургическое лечение. Преимущества резекции метастазов, усиливаемые дополнительной лучевой терапией, были продемонстрированы в контролируемых исследованиях. Резекция оправдана во всех случаях при очаге более 3 см, при легкой доступности и при обширном перифокальном отеке. Кроме того, хирургическое лечение показано при инфратенториальном поражении с угрозой развития обструктивной гидроцефалии, и может рассматриваться даже при сложной локализации, например, в пинеальной области, где резекция немедленно восстанавливает ликворопроводящие пути.
До трех очагов могут быть легко удалены во время одного хирургического вмешательства, даже в инфратенториальной и супратенториальной областях.
Удаление метастазов головного мозга проводиться in toto (целиком), по возможности даже с резекцией части околоочагового белого вещества. Возможность выполнения такого вмешательства определяет и выбор дополнительного лечения. Резекция в целом, очевидно, невозможна при больших кистозных поражениях, которые имеют более высокую склонность к местному рецидивированию и в этих случаях бывает желательно дополнительное облучение либо всего мозга либо пораженного поля.
2. Лучевая терапия метастазов в мозг. В качестве альтернативы хирургического лечения часто используется стереотаксическая радиохирургия. Подходящими для данного метода являются очаги идеальной сферической формы при размере менее 3 см. Множественные поражения также могут подвергаться радиохирургии. Стереотаксическая радиохирургия может быть использована в сочетании с открытой хирургией или лучевой терапией всего головного мозга.
Облучение всего мозга проводится, когда имеет место распространенное заболевание и нет другого выбора. При этом могут иметь место серьезные нейрокогнитивные последствия.
е) Дифференциальный диагноз. В связи с контрастным усилением и центральным некрозом метастазы имитируют полноценные глиомы. Из-за сферической формы и кольцевого маргинального усиления иногда сложно дифференцировать метастазы от абсцессов мозга. В настоящее время это легко решается с помощью ADC последовательности МРТ, которая помогает надежно различить эти процессы.
ж) Прогноз. Прогноз для пациентов с метастазами, как правило, плохой, и выживаемость не превышает одного года. Когда системное заболевание контролируется, а также возможно агрессивное лечение метастазов головного мозга, можно получить относительно продолжительный период ремиссии. При множественных, широко распространенных, не поддающихся лечению метастазах выживаемость падает до 4-6 недель.
з) Европейский стандарт лечения метастазов мозга:
— Когда известен первичный очаг, обсуждению терапевтических возможностей должна предшествовать тщательная оценка. МРТ является обязательным диагностическим методом.
— Желательно контролирование системного заболевания при лечении метастазов ЦНС. Ожидаемая продолжительность жизни должна составлять, по крайней мере, шесть месяцев.
— Лечение метастазов головного мозга включает микрохирургическую резекцию, диагностическую стереотаксическую биопсию с последующим облучением (весь мозг или стереотаксическая радиохирургия), химиотерапия или любая комбинация методов.
— Следует избегать шунтирования, а в случаях обструктивной гидроцефалии может быть показана тривентрикулостомия.
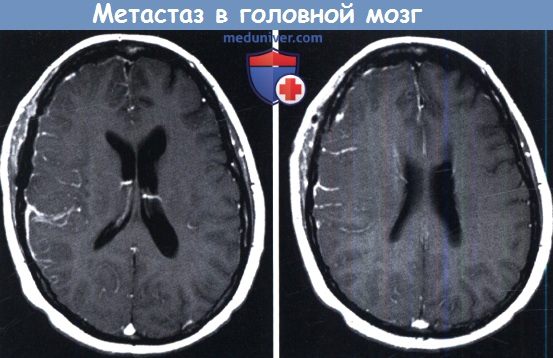
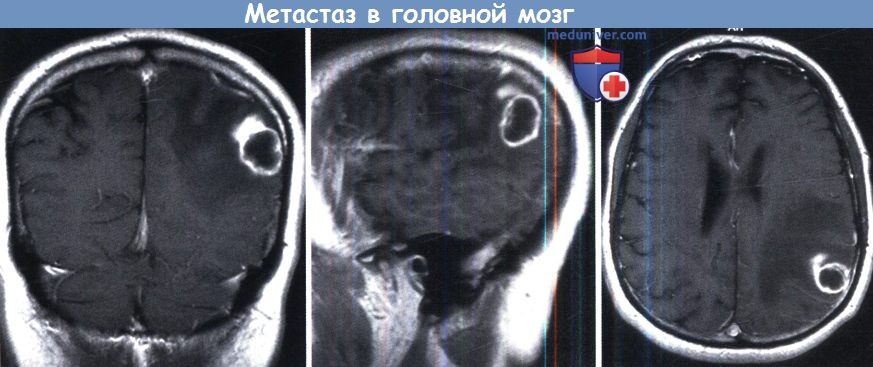
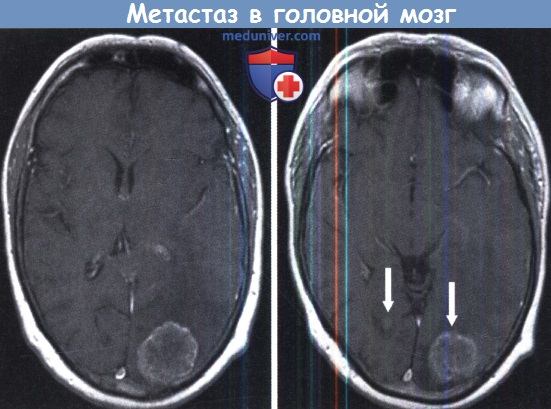
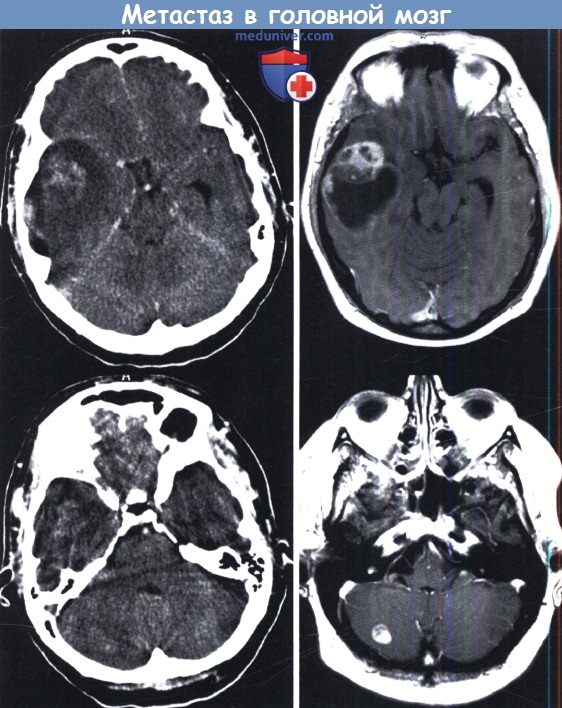
Инфратенториальный очаг гораздо лучше визуализируется на МРТ. 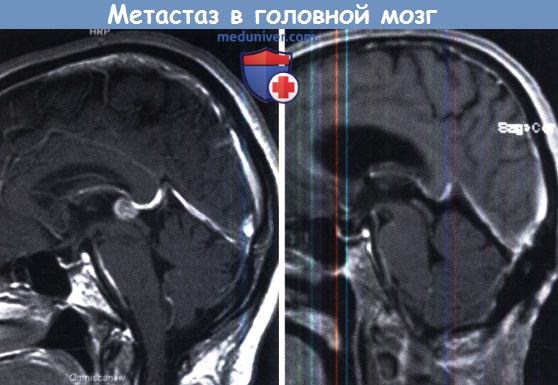
и компрессией четверохолмной пластинки, который может быть легко резецирован. 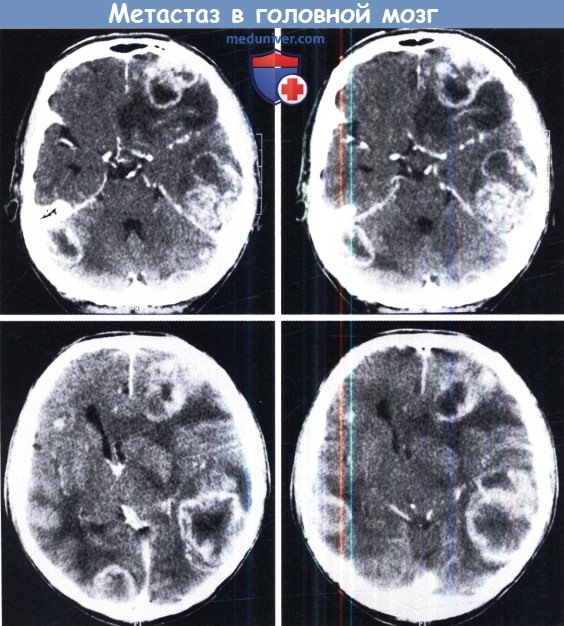
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Метастазы в головной мозг
в 50% случаев. Четвертое и пятое место по частоте причин развития интрацеребральных метастазов занимают злокачественные опухоли мочеполовой системы и колоректальный рак соответственно. Особенность молодых пациентов заключается в том, что у них чаще всего источником метастазов в головной мозг являются различные виды саркомы и герминативно-клеточные опухоли.
Примерно в половине случаев метастазирование в головной мозг имеет множественный характер, то есть выявляется сразу несколько очагов, подчас их общее число не поддается подсчету. При этом установлено, что метастазы рака почки и колоректального рака чаще одиночные, а меланомы и рака легкого – чаще носят множественный характер.
«Излюбленной» локализацией метастазов является задняя черепная ямка (мозжечок). В ряде случаев наблюдается кровоизлияние в строму метастатического узла (клинический случай №6).
У 15% пациентов с гистологически верифицированными метастазами рака в головной мозг (после операции удаления или – существенно реже – после стереотаксической биопсии) не удаётся выявить первичную опухоль с помощью современных инструментальных методик обследования (клинический случай №1). При катамнестическом наблюдении, однако, у большинства из них выявляется рак легкого.
Гистологическая структура первичной опухоли и ее метастаза в головной мозг идентична (при возможных отличиях в биологическом поведении и генетических характеристиках), поэтому иммуногистохимическое исследование, проводимое в лабораториях крупных специализированных нейрохирургических центров, способно в большинстве случаев с известной точностью установить источник метастазирования при невыявленной первичной злокачественной опухоли.
Нужно помнить, что, к сожалению, одно заболевание не исключает другое. Не все новообразования, имеющие МР-характеристики метастаза в головной мозг, у пациента с верифицированной опухолью другой локализации, обязательно будут ее метастазами (клинический случай №3).
Клинические проявления метастазов рака в головной мозг
Ткань метастаза, окружающий ее отек, а также в ряде случаев кровоизлияния в строму опухолевого узла создают «масс-эффект». Также может наблюдаться препятствие для ликвороциркуляции – обструкция ликворных путей с развитием гидроцефалии (клинический случай №2) и в ряде случаев быстрым нарастанием неврологической симптоматики.
Наиболее частые клинические проявления метастатического поражения головного мозга:
— головная боль
выявляется почти у половины пациентов, чаще при множественном поражении головного мозга или при вовлечении структур задней черепной ямки. Чаще головная боль усиливается в утренние часы, а также при физической нагрузке, натуживании, кашле итд. Зачастую сопровождается тошнотой и рвотой.
— эпилептические приступы
примерно в 20% случаев бывают первым проявлением интрацеребральных метастазов и приблизительно с такой же частотой возникают в процессе лечения заболевания
— фокальный неврологический дефицит
Развитие слабости в руке/ноге, в ряде случаев до полного отсутствия произвольных движений, речевых или зрительных расстройств встречается примерно у 40% больных с метастазами в головной мозг
— интеллектуально-мнестические нарушения, расстройства поведения, личностные расстройства, депрессии встречаются очень часто, однако лишь иногда озвучиваются в виде жалоб пациента и потому зачастую остаются недооцененными
— расстройства походки – даже в отсутствии снижения силы в нижних конечностях и/или поражения мозжечка, часто бывают первым проявлением метастатического поражения головного мозга и возникают в основном при множественных метастазах, локализованных в обоих полушариях
Инструментальная диагностика метастазов в головной мозг
Несмотря на то, что метастазы не имеют патогномоничных МР-признаков, МРТ все же остается непревзойденной методикой для их диагностики, существенно превосходя возможности компьютерной томографии (КТ), поскольку имеет более высокое разрешение и не ограничено артефактами от костной ткани.
В ряде случаев метастазы могут имитировать другие (первичные) опухоли и зачастую пациенты приходят ко мне с неверными направительными диагнозами, особенно в случаях невыявленного первичного источника. Однако детальный анализ качественных снимков практически всегда позволяет поставить верный диагноз на дооперационном этапе (клинический случай №5).
Метастазы могут локализоваться в любом отделе ЦНС и в ряде случаев их удаление сопряжено с высоким риском развития неврологического дефицита, например, при локализации в функционально значимой зоне или в тесном контакте с магистральными артериями головного мозга (клинический случай №4).
У пациентов с выявленным предположительно метастатическим поражением головного мозга дополнительное инструментальное обследование должно включать тщательный осмотр всей поверхности кожи (на предмет наличия меланомы), КТ грудной клетки и брюшной полости, а также, по возможности, позитронно-эмиссионную томографию с глюкозой (ПЭТ-КТ с 18F-FDG) всего тела с целью поиска первичного источника.
Наиболее информативным исследованием (по статистике) является КТ грудной клетки, поскольку примерно у 60% пациентов с невыявленным первичным источником метастазов в головной мозг при данном исследовании выявляется злокачественная опухоль легкого.
В том случае, если вышеназванные исследования не позволили выявить первичную опухоль, необходимо проведение операции удаления очага в головном мозге, а при невозможности проведения этой операции (по ряду причин: глубинная локализация, большой объем, их сочетание и др., а также вследствие тяжести состояния больного) целесообразно рассмотреть вопрос о проведении стереотаксической биопсии.
Исследование онкомаркеров крови (при опухолях молочной железы, яичников, поджелудочной железы) имеет ориентировочное значение и является более информативным лишь в случае редких – герминативноклеточных – опухолей (альфа-фетопротеин, бета-хорионический гонадотропин человека).
Материалы конгрессов и конференций
X РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ КОНГРЕСС
ЛУЧЕВАЯ ТЕРАПИЯ В КОМБИНИРОВАННОМ И КОМПЛЕКСНОМ ЛЕЧЕНИИ МЕТАСТАЗОВ
В ГОЛОВНОЙ МОЗГ: ОСНОВНЫЕ ЭТАПЫ, ПЕРСПЕКТИВЫ
З.П. Михина, С.И. Ткачев, О.П. Трофимова, В.С. Данилова, О.П. Извекова,
В.А. Горбунова, М.Б Бычков, Р.Б. Карахан, В.Б. Крат
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, Москва
Метастатическое поражение головного мозга – серьезное осложнение течения опухолевого процесса, которое отмечается примерно у 50% онкологических больных и чаще всего встречается при раке легкого (34–66%), молочной железы (10–33%), почки, колоректальном раке, меланоме. Пик метастазов приходится на возрастную группу 55-65 лет. В детском возрасте метастазы в мозг возникают чаще при саркоме Юинга, рабдомиосаркоме, нейробластоме и остеогенной саркоме (1, 2).
При подозрении или выявлении метастазов в головной мозг должно проводиться полное общее обследование, и оно особенно показано пациентам с поражением мозга без выявленной первичной опухоли и больным с известным первичным диагнозом рака, у которых была некоторое время ремиссия. Начальная оценка состояния больного с поражением ЦНС должна проводиться с использованием шкалы Карновского или системы ВОЗ. Обе системы позволяют количественно определить функциональное состояние больного, прогнозировать качество и время жизни, определять объем обследования.
Клинический осмотр больного должен включать тщательную пальпацию всех периферических лимфатических узлов, щитовидной железы, молочных желез, выслушивание легких, обследование брюшной и тазовой области, включая яички, ректальное исследование, осмотр всей кожи для выявления меланомы. Следует выяснить жалобы на боли в костях, потому что метастазы в кости и мозг нередко встречаются вместе.
Тщательная неврологическая оценка часто показывает дефициты, которые пациент не сознавал, особенно локальную слабость и умственные изменения. Следует исследовать зрение, которое отражает кортикальную функцию и внутричерепное давление. До 25% больных с метастазами в мозг имеют отек диска зрительного нерва, изолированный паралич VI (отводящего) нерва может быть неправильно истолкован как локальный симптом, хотя он отражает внутричерепную гипертензию.
При подозрении или установления диагноза метастаза в мозг у онкологического больного следует начать терапию с учетом степени тяжести неврологических симптомов. При выраженном внутричерепном давлении с признаками, предполагающими наличие вклинения мозга, или при эпилептическом состоянии показан маннитол 1 г/кг внутривенно и дексаметазон от 32 до 64 мг внутривенно струйно. Поддерживающие дозы маннитола (0.5-2 г/кг) и дексаметазона (4-10 мг в/в) вводятся, разделенные на 4 дозы. При эпилептическом статусе последовательно вводятся противосудорожные препараты: лоразепам от 1 до 4 мг в/в, далее фосфенитоин 20 мг/кг, в/в, фенобарбитал, пропофол, вплоть до общей анестезии, если нет стойкого эффекта.
Дексаметазон – глюкокортикоид, наиболее часто используемый для уменьшения отека мозга. Уменьшение отека с последующим клиническим улучшением обычно наблюдается в пределах 1-2 дней. Стандартный подход у больных с симптомами заключается в подведении высокой начальной дозы, от 16 до 32 мг в/в или в/м с последующим снижением дозы до 4-8 мг в/в или per os. При наступлении устойчивого клинического улучшения следует начать медленное снижение доза дексаметазона до самой низкой эффективной, например, по 2 мг каждые 5-7 дней. Следует не забывать, что длительное использование кортикостероидов связано с высокой частотой побочных эффектов, таких как кандидоз полости рта, повышение кислотности желудка, язвенная болезнь, условно-патогенные инфекционные процессы, отсутствие толерантности к глюкозе или свершившийся диабет, артериальная гипертензия, кушингоидные изменения, нарушения сна, личности, остеопороз, аваскулярный некроз, риск тромбоза глубоких вен. Не рекомендуется использовать кортикостероиды у пациентов с отсутствием или минимальными симптомами (1, 2).
Облучение всего головного мозга в самостоятельном варианте используется у больных с милиарной диссеминацией метастазов, с множественным или ограниченным числом очагов (2-4), но при неблагоприятном прогнозе. Весь мозг облучается при метастазах лимфосарком, мелкоклеточного рака легкого (МРЛ), герминогенных опухолей, при которых хирургическое лечение проводить нецелесообразно, но лучевая терапия обязательно дополняется химиотерапией, к которой опухоли данных локализаций высоко чувствительны.
WBRT проводится с профилактической целью после хирургического удаления одиночных метастазов или при МРЛ, аденокарциноме легкого, лейкозах, учитывая высокий потенциал интракраниального метастазирования при указанных формах первичной опухоли.
Параллельно с лучевой терапией у больных с одиночными метастазами использовался хирургический метод в самостоятельном варианте. При числе метастазов 2-3 хирургическое лечение считалось противопоказанным (3).
После представленных итогов возникли вопросы относительно роли лучевой терапии: необходима ли вообще лучевая терапия после «полной» резекции одиночного метастаза, должна ли послеоперационная лучевая терапия быть локальной или ее следует проводить в виде WBRT.
Ретроспективные исследования, которые изучали роль послеоперационной лучевой терапии при одном метастазе, не сумели ответить на этот вопрос из-за противоречивых результатов. Четко отмечалась меньшая частота рецидива в зоне операции и в других отделах мозга при использовании WBRT, не было единого мнения о пользе для выживаемости, оставалась высокая вероятность развития поздних лучевых повреждений мозга, снижающих качество жизни больных.
Patchell и соавт. опубликовали результаты рандомизированного исследования, определяющего важность включения WBRT. Больные в общем состоянии >70 баллов по шкале Карновского были рандомизированы после полного удаления единичного метастаза в головном мозге. Для увеличения эффекта и снижения возможного нейрокогнитивного ухудшения использовалась классическая лучевая терапия (СОД 50,4 Гр; РОД 1,8 Гр). Анализа данных показал достоверное уменьшение частоты рецидивов (18% против 70%) и причин смерти от неврологической болезни (14% против 44%) у больных с WBRT после хирургического удаления по сравнению с хирургией в самостоятельном варианте. Однако пользы для выживаемости или функциональной независимости больных отмечено не было. Авторы рекомендовали применять WBRT для уменьшения частоты локальных или новых метастазов в головном мозге и снижения вероятности смерти по неврологическим причинам.
WBRT обычно назначается всем пациентам после резекции 2-3 метастазов, даже, когда послеоперационные исследования (КТ и МРТ) не показывают наличие болезни. Высокая вероятность появления новых метастазов в мозге оправдывает применение WBRT после операции, не смотря на потенциальный риск постлучевых изменений. В настоящее время окончательное решение принимается с учетом полноты резекции очагов, чувствительности опухоли к облучению, наличия экстракраниальных метастазов и прогнозирования длительности выживания.
Оценка больших клинических материалов показала, что приблизительно 50% пациентов с метастазами в мозг умирают от неврологических причин (4). Было высказано предположение, что если подводить к метастазам бoльшие дозы, выживаемость может быть увеличена. Были проверены стратегии по увеличению доз облучения с использованием ускоренной гиперфракционной радиотерапии, брахитерапии, фракционированной стереотаксической радиохирургии и стереотаксической радиохирургии (SRS) в виде одной дозы. В последнем десятилетии наиболее активно использовалась SRS с подведением к опухоли всей дозы за один сеанс с минимальной дозой в нормальной ткани мозга.
SRS радиохирургия использует множество мелких, хорошо коллимированых пучков ионизирующего излучения линейного ускорителя или «гамма-ножа» для уничтожения внутричерепных очагов. Анализ 40 нерандомизированных исследований, включавших 2,697 пациентов и 3,922 метастатических очагов, выявил среднюю частоту непосредственного эффекта в 81% случае при использовании SRS.
Активное внедрение в ряде стран SRS для лечения интракраниальных метастазов позволило высказать сомнения в целесообразности использовании WBRT у пациентов с несколькими метастазами.
В настоящее время продолжаются или уже опубликованы предварительные результаты ряда рандомизированных исследований, касающихся более детальной и ясной оценки роли WBRT в сочетании с радиохирургией. Исследование Aoyama и соавт. (5) было проведено в Японии с участием больных с 1-4 метастазами, состоянием ≥70 баллов по шкале Карновского, размерами метастазов по МРТ ≤3 см, получивших радиохирургию в сочетании или без WBRT. Проведено сравнение в группах в зависимости от числа метастазов (1 против 2-4), вида первичной опухоли (легкое против других опухолей), состояния экстракраниальной болезни (есть – нет). WBRT проводилась по схеме 30 Гр за 10 фракций, дозы SRS уменьшались на 30-40% на краях метастазов в группе WBRT+SRS. Первично изучалась выживаемость, вторично – сохранение системных функций (KRS ≥70%), сохранение неврологического статуса (RTOG, стадия ≤2), время, свободное от новых интракраниальных метастазов, поздние неблагоприятные последствия, причины смерти по определению Patchell, частота локального контроля в области поражения.
Начиная с 80 гг., с внедрением новых диагностических методов (КТ, МРТ), основное внимание уделялось совершенствованию методов диагностики внутримозговых метастазов, определению прогностических групп, разработке методов лечения с учетом прогноза. На основе изучения прогностических факторов 1176 больных исследователи RTOG, используя статистический метод, названный рекурсивным парциальным анализом (RPA), выделили три подгруппы (классы). Рекурсивный класс I включал пациентов до 65 лет, в общем состоянии по шкале Карновского ≥70%, излеченной или контролируемой основной опухолью и отсутствием внечерепных метастазов. Эта группа составляла меньше 20% от общей численности пациентов с метастазами в мозг. Класс III включал пациентов в общем состоянии по шкале Карновского 90% пациентов с метастазами в мозг до лучевой терапии всего черепа имелиcь нарушения познавательной функции, которые в значительной степени зависели от объема опухоли, но не от числа метастазов, и исходный уровень этой функции был значительным прогностическим признаком выживаемости, помимо обычных используемых показателей прогноза.
Поздние изменения мозга после WBRT имеют особый интерес, поскольку они включают возможность появления деменции. Важно, что деменции, частота которой с течение первого года после WBRT составляла 11%, была выявлена только у пациентов, леченных большими ежедневными фракциями (больше 3 Гр). В то же время приведены веские доводы в пользу того, что лечение крупными фракциями позволяет быстрее получить эффект с улучшением неврологических симптомов и уменьшить время приема поддерживающих лекарств. Кроме того, больные с неблагоприятным прогнозом имеют небольшую выживаемость, и у них не успевает развиться такое серьезное осложнение как деменция. Однако выживаемость у части больных растет, и при хорошем прогнозе больные могут дожить до поздних повреждений, что заставляет изучать факторы, определяющие позднюю нейротоксичность.
Таблица 2.
Лучевые осложнения после облучения черепа.
| Фаза | Признаки | Время появления | Вероятная причина | Лечение |
|---|---|---|---|---|
| Острая | Усталость, головная боль, тошнота, алопеция, эритема кожи черепа, обострение локального неврологического дефицита | Первые 2 недели лучевой терапии | Отек | Кортикостероиды |
| Ранняя отсроченная | Усталость, сонливость, головная боль → познавательная дисфункция → замедленная обработка информации → снижение внимания → неспособность обучения; нарушение памяти → исполнительная дисфункция → нарушение моторной ловкости | 1-6 мес. после лучевой терапии | Демиелинизация | Кортикостероиды, возможно спонтанное улучшение |
| Поздние нарушения | Деменция, изменение личности, лейкоэнцефалопатия, судороги, повышение черепно-мозгового давления, атаксия, дизартрия, несдержанность, оптическая невропатия, индуцированные опухоли | От 6 мес. до нескольких лет после лучевой терапии | Ангиопатия, демиелинизация, некроз | Кортикостероиды, антикоагулянты, вит. Е |
В заключение следует отметить, что решение клинической проблемы должно основываться на оценке прогностических показателей. Это позволяет разделить больных на благоприятные, промежуточные, и неблагоприятные категории и предложить методы лечения (резекцию, облучение, радиохирургию, химиотерапию), которые разработаны в конкретном учреждении и доступны больным.
В странах с большим опытом применения стереотаксической радиохирургии до конца не определено место метода в лечении метастазов: должна ли радиохирургия использоваться в сочетании с WBRT для предупреждения рецидивов и новых метастазов или во время рецидива после WBRT, или использоваться самостоятельно, резервируя WBRT для облучения обширных мозговых рецидивов. В России только набирается опыт лечения с использованием гамма-ножа, нет пока исследований по обоснованному сочетанию радиохирургии с различными методами лечения. В связи с этим общее облучение мозга проводится практически всем больным (после операции, самостоятельно), и при показаниях добавляется локальное облучение отдельных очагов на линейных ускорителях. Дальнейшие исследования должны обязательно включать оценку реакций на облучение всего мозга с изучением познавательной функции путем анкетирования больных с различными первичными новообразованиями, имеющими шанс прожить более 3 мес.
1. Evaluation and management of brain metastases. /Mehta M., Tremont-Lukats I.W Educational Lection of the 38th ASCO Annual Meeting 18-21 May, 2002, Orlando, FL, USA — 2002. — P.375—82.
2. Treatment of brain metastases. / Patchell R.A. Educational Lection of the 38th ASCO Annual Meeting 18-21 May, 2002, Orlando, FL, USA — 2002. — P. 383—91.
3. Management of cerebral metastases: the role of surgery/ Lang F.F., Wildrick D.M., Sawaya R. — Cancer Control. — 1998, Mar. — Vol. 5. — No. 2. — P.124—9.
4. Focal management of single or multiple brain metastasis without whole-brain radiotherapy. / Kleinberg L.R Educational Lection of the 42nd ASCO Annual Meeting, 2006 — P. 93—9.
5. Interim report of the JROSG99-1 multi-institutional randomized trial, comparing radiosurgery alone vs. radiosurgery plus whole brain irradiation for 1-4 brain metastases. /Aoyama H, Shirato H, Nakagawa K, et al. J Clin Oncol.—2004—22 (suppl; abstr 1506)14s.
6. Phase II trial of radiosurgery for one to three newly diagnosed brain metastases from renal cell carcinoma, melanoma, and sarcoma. / Manon R, O’Neill A, Knisely J, et al. An Eastern Cooperative Oncology Group study (E 6397). J Clin Oncol.— 2005. —23. — P. 8870-8876.
7. Clinical practice guideline on the optimal radiotherapeutic management of brain metastases/ Tsao M.N., Lloyd N.S., Wong R.K.S. and the Supportive Care Guidelines Group of Cancer Care Ontario’s Program in Evidence-based Care. — BMC Cancer. — 2005. — Vol. 5 — P.34.
8. Neurocognitive sequelae оf whole-brain radiotherapy in patients with brain metastase. /Jeffrey S. Educational Lection of the 42nd ASCO Annual Meeting, 2006 — P.100—4.

