чем обусловлена геометрическая форма молекул
Гибридизация электронных орбиталей и геометрия молекул
В 1930 г. Слейтером и Л. Полингом была развита теория образования ковалентной связи за счет перекрывания электронных орбиталей – метод валентных связей. В основе этого метода лежит метод гибридизации, который описывает образование молекул веществ за счет «смешивания» гибридных орбиталей («смешиваются» не электроны, а орбитали).
Определение типа гибридизации молекул с ковалентной связью
Определить тип гибридизации можно только для молекул с ковалентной связью типа АВn, где n больше или равно двум, А – центральный атом, В – лиганд. В гибридизацию вступают только валентные орбитали центрального атома.
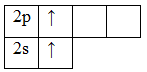
Определим тип гибридизации на примере молекулы BeH2.
Первоначально записываем электронные конфигурации центрального атома и лиганда, рисуем электронно-графические формулы.
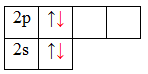
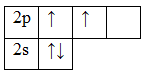
Атом бериллия (центральный атом) имеет вакантные 2p-орбитали, поэтому, чтобы принять по одному электрону от каждого атома водорода (лиганд) для образования молекулы BeH2 ему необходимо перейти в возбужденное состояние:
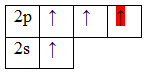
Образование молекулы BeH2 происходит за счет перекрывания валентных орбиталей атома Be
* красным цветом обозначены электроны водорода, черным – бериллия.
Тип гибридизации определяют по тому, какие орбитали перекрылись, т.о., молекула BeH2 находитс в sp – гибридизации.
Помимо молекул состава ABn, методом валентных связей можно определить тип гибридизации молекул с кратными связями. Рассмотрим на примере молекулы этилена C2H4. В молекуле этилена кратная двойная связь, которая образована 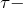
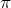
У атома углерода имеется еще одна вакантная p-орбиталь, следовательно, чтобы принять 4 атома водорода ему необходимо перейти в возбужденное состояние:
Определение геометрической структуры молекул
Геометрическую структуру молекул, а также катионов и анионов состава АВn можно с помощью метода Гиллеспи. В основе этого метода – валентные пары электронов. На геометрическую структуру оказывают влияние не только электроны, участвующие в образовании химической связи, но и неподеленные электронные пары. Каждую неподеленную пару электронов в методе Гиллеспи обозначают Е, центральный атом – А, лиганд – В.
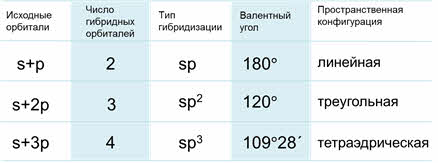
Если неподеленных электронных пар нет, то состав молекул может быть АВ2 (линейная структура молекулы), АВ3 (структура плоского треугольника), АВ4 (тетраэдрическая структура), АВ5 (структура тригональной бипирамиды) и АВ6 (октаэдрическая структура). От базисных структур могут быть получены производные, если вместо лиганда появляется неподеленная электронная пара. Например: АВ3Е (пирамидальная структура), АВ2Е2 (угловая структура молекулы).
Чтобы определить геометрическую структуру (строение ) молекулы необходимо определить состав частицы, для чего вычисляют количество неподеленных лектронных пар (НЕП):
НЕП = (общее число валентных электронов – число электронов, пошедших на образование связи с лигандами) / 2
На связь с H, Cl, Br, I, F уходит по 1-му электрону от А, на связь с O – по 2 электрона, а на связь с N – по 3 электрона от центрального атома.
Рассмотрим на примере молекулы BCl3. Центральный атом – B.
НЕП = (3-3)/2 = 0, следовательно неподеленных электронных пар нет и молекула имеет структуру АВ3 – плоский треугольник.
Подробно геометрическое строение молекул разного состава представлено в табл. 1.
Таблица 1. Пространственное строение молекул
Гибридизация атомных орбиталей. Геометрия молекул
Урок 10. Химия 11 класс ФГОС
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности
Конспект урока «Гибридизация атомных орбиталей. Геометрия молекул»
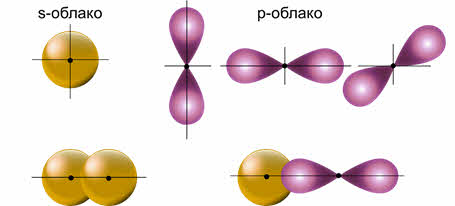
В образовании ковалентных связей принимают участие как эс-, так и пэ-электроны, орбитали которых имеют различную форму и направленность в пространстве.
Связи, которые образуются между ними, являются равноценными и расположены симметрично.
Это явление объясняется на основе концепции гибридизации атомных валентных орбиталей. Согласно концепции, в образовании химической связи принимают участие гибридные орбитали, то есть это орбитали, усреднённые по форме и размерам, а, следовательно, и по энергии. Число гибридных орбиталей равно числу исходных.
Гибридные орбитали более вытянуты в пространстве, а это обеспечивает их более полное перекрывание с орбиталями соседних атомов.
Из-за своей симметрии гибридные орбитали не участвуют в образовании пи-связи, так как не могут обеспечить перекрывание между собой в двух областях пространства.
Основными условиями устойчивой гибридизации являются:
Первое, в гибридизации могут участвовать орбитали с близкими значениями энергий, то есть эс-, пэ-орбитали внешнего энергетического уровня и дэ-орбитали внешнего или предвнешнего уровня;
второе, гибридная атомная орбиталь должна более плотно перекрываться с орбиталями другого атома при образовании связи;
третье, в гибридизации участвуют орбитали с достаточно высокой электронной плотностью, которыми в большинстве случаев являются орбитали элементов начальных периодов;
четвёртое, гибридные орбитали должны быть ориентированы в пространстве таким образом, чтобы обеспечить максимальное взаимное удаление друг от друга.
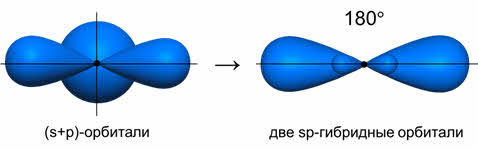
Ориентация гибридных орбиталей определяет геометрическую структуру молекулы. При комбинации одной эс- и одной пэ-орбитали возникает две эс-пэ-гибридные орбитали, расположенные симметрично под углом сто восемьдесят градусов.
Связи, образованные с участием электронов этих орбиталей, также располагаются под углом сто восемьдесят градусов.
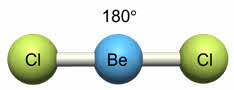
Например, у атома бериллия эс-пэ-гибридизация орбиталей проявляется в молекуле хлорида бериллия, которая вследствие этого имеет линейную форму.
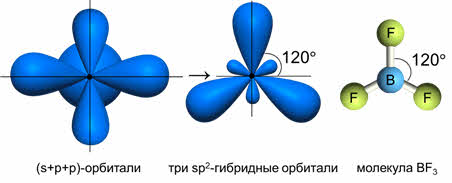
Комбинация трёх орбиталей (одной эс- и двух пэ-орбиталей) приводит к образованию трёх эс-пэ-два гибридных орбиталей, расположенных под углом сто двадцать градусов, как в молекуле фторида бора.
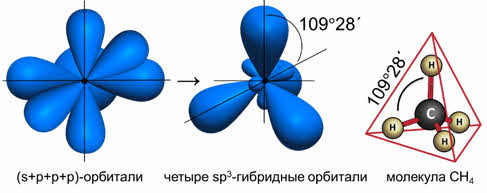
Комбинация четырёх орбиталей (одной эс- и трёх пэ-типа) приводит к эс-пэ-три гибридизации, при которой четыре гибридные орбитали симметрично ориентированы в пространстве к четырём вершинам тэтраэдра, то есть под углом сто девять градусов двадцать восемь минут, как в атоме углерода в молекуле метана.
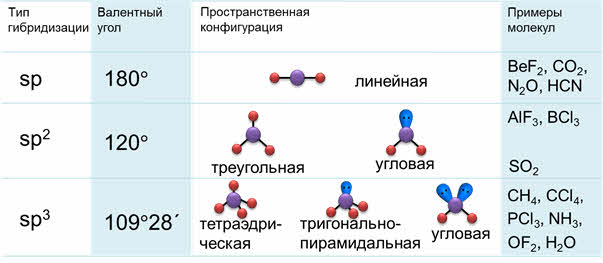
Таким образом, если исходными орбиталями являются эс- и пэ-, то образуется две гибридные орбитали, возникает гибридизация эс-пэ типа, связи при этом расположены под углом сто восемьдесят градусов, в пространстве молекула имеет линейное строение.
Если исходные орбитали одна эс и две пэ-орбитали, то образуется три гибридных орбитали, тип гибридизации при этом эс-пэ-два, валентный угол равен сто двадцать градусов, а форма молекулы треугольная.
Если в гибридизации участвуют одна эс и три пэ-орбитали
то образуется четыре гибридных орбитали, возникает эс-пэ-три гибридизация, валентный угол при этом сто девять градусов двадцать восемь минут, а форма молекулы тэтраэдрическая.
Основные характеристики разных типов гибридизации
Пространственное строение молекул или ионов зависит от типа гибридизации и взаимного расположения в пространстве гибридизированных орбиталей.
Часто в молекулах углы между связями отличаются от углов, соответствующих типу гибридизации. Почему же так происходит?
Во-первых, геометрическая конфигурация молекул определяется в основном пространственной направленностью сигма-связей. Устойчивому состоянию молекулы соответствует такое пространственное расположение электронных облаков валентного слоя, при котором их взаимное отталкивание минимально. Поэтому такие электронные пары стремятся максимально оттолкнуться друг от друга, располагаясь в пространстве под возможно большим углом.
Основными причинами отклонений углов связей от углов, соответствующих типу гибридизации являются:
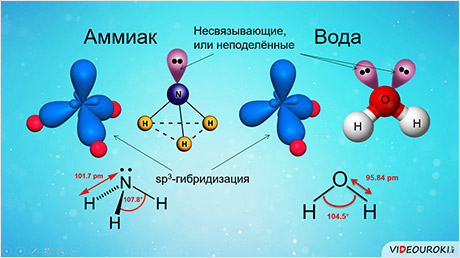
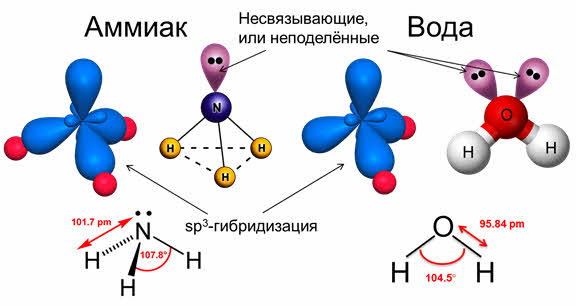
во-первых, не все гибридные орбитали участвуют в образовании связей, часть из них – несвязывающие. Электронные пары, находящиеся на этих орбиталях, называются несвязывающими, или неподелёнными. Так, в молекуле аммиака у атома азота одна пара электронов – не связывающая, в молекуле воды у атома кислорода две пары электронов являются несвязывающими.
Связывающая электронная пара локализована между атомами и поэтому занимает меньше пространства, чем электронное облако несвязывающей пары. Поэтому отталкивающее действие несвязывающей пары проявляется в большей мере, чем связывающей. В молекуле воды и аммиака у атомов азота, и кислорода один и тот же тип гибридизации атомных орбиталей – эс-пэ-три. Однако из-за наличия одной у азота и двух у кислорода несвязывающих пар электронов идеальный угол для этого типа гибридизации, равный сто девять градусов двадцать восемь минут, уменьшается до ста семи градусов у аммиака и ста четырёх с половиной у воды.
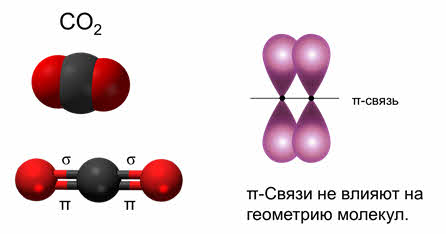
Второй причиной отклонений углов связей является наличие пи-связей, которые влияют на величину валентного угла, но это не сказывается на типе гибридизации и геометрии молекулы.
Предполагают, что электронные пары кратной связи занимают ту же область пространства, что и электронная пара простой связи. Суммарное электронное облако кратной связи занимает больший объём пространства, чем одинарной и поэтому обладает большим отталкивающим действием.
Так, в молекуле углекислого газа две ковалентные связи одинарные, так как являются сигма-связями, а две другие связи – это пи-связи. Пи-связи не влияют на геометрию молекул, поэтому в пространстве молекула углекислого газа имеет линейное строение, и здесь эс-пэ-тип гибридизации.
Виды геометрических конфигураций
Молекулы с эс-пэ-гибридизацией имеют линейное строение. Валентный угол при этом сто восемьдесят градусов. К таким молекулам относятся фторид бериллия, молекула углекислого газа, оксида азота один, синильной кислоты.
В молекулах с эс-пэ-два-гибридизацией валентный угол сто двадцать градусов, форма молекулы может быть треугольной, как у фторида алюминия, хлорида бора, так и угловой, как у молекулы оксида серы четыре.
В молекулах с эс-пэ-три-гибридизацией валентный угол сто девять градусов двадцать восемь минут. Молекулы могут иметь тэтраэдрическое строение, как молекула метана, тэтрахлорметана, а также тригонально-пирамидальное строение, как у хлорида фосфора три, аммиака, или угловое строение, как у фторида кислорода и воды.
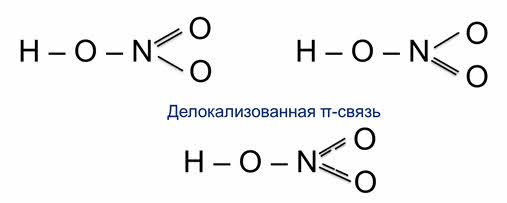
Иногда строение многих молекул нельзя изобразить такой одной графической формулой, потому что истинные свойства молекулы оказываются промежуточными между теми, которые отражаются в каждой отдельной схеме. Так, строение молекулы азотной кислоты можно изобразить двумя равнозначными графическими формулами. Так как в этой молекуле два атома кислорода равноценны, строение молекулы лучше отражает графическая формула с дэлокализованной пи-связью. Пунктирные линии означают, что одна из общих электронных пар в равной степени распределена между одной и другой связями. Эта электронная пара принадлежит не двум, а трём атомам, поэтому образованная таким образом связь является трёхцентровой.
Таким образом, гибридные орбитали должны быть ориентированы в пространстве таким образом, чтобы обеспечить максимальное взаимное удаление друг от друга. Гибридные орбитали участвуют в образовании только сигма-связи.
Геометрия любой молекулы определяется пространственной направленностью сигма-связью. На пространственное строение молекулы оказывают влияние несвязывающие пары электронов, которые уменьшают углы связей между сигма-связями.
Презентация на тему «Геометрия молекул» (11 класс, профильный уровень)
Выбранный для просмотра документ другие виды гибридизации.pptx
Описание презентации по отдельным слайдам:
Соединения с Sp3 –гибридными орбиталями
Sp3 –гибридизация NCl3 N 2S2 2p3
Sp3 –гибридизация H2O О 2S2 2p4
Как определить тип гибридизации? Какие виды гибридизации орбиталей вам известны? Какой тип химической связи (σ или π) является определяющим для геометрии молекулы?
Sp-гибридизация наблюдается во всех ацетиленовых углеводородах; также у : карбина, BeCl2, BeH2, CO, CO2, HCN. Ве* 2S1 2p1 выравнивание
Упражнение: Соберите из конструктора модели молекул и сравните: а) CO2, SO2; б)SO3. Определите тип гибридизации орбиталей центрального атома и форму молекул.
Валентность центрального атома в молекулах C* 2S2 2p3 выравнивание S* 3S2 3p3 3d1 выравнивание CO2 SO2 2πсвязи валентностьIV 2πсвязи валентностьIV
Гибридизация и геометрия молекул CO2 SO2 гибридизация sp sp2 угол связи 1800 1200 форма молекулы линейная угловая
на геометрию молекул влияют
Другие виды гибридизации Помимо энергетических уровней s и p, в процессе гибридизации могут также участвовать d- и f-уровни. Форма этих орбиталей зависит от магнитного квантового числа, характеризующего орбиталь.
Даны вещества: SCl4, SF6, XeF6 Что общего у этих веществ? Что различного у этих веществ? Как будет меняться тип гибридизации центрального атома? Упражнение:
Гибридизация и геометрия молекулы SCl4 3S2 3p3 3d1 выравнивание S* SCl4 валентность IV гибридизация Sp3d(5 гибридных АО) угол связи 1200, 900 форма молекулы треугольнаябипирамида
Гибридизация и геометрия молекулы SF6 3S1 3p3 3d2 выравнивание S* SF6 валентность VI гибридизация sp3d2(6 гибридных АО) угол связи 900,900,1800 форма молекулы четырёхугольнаябипирамида(октаэдр)
Гибридизация и геометрия молекулы XeF6 5S2 5p3 5d3 выравнивание Xe* XeF6 валентность центр.атома VI гибридизация sp3d3(7 гибридных АО) угол связи 720,900 форма молекулы пятиугольная пирамида
Упражнения: Определить тип гибридизации центрального атома в молекулах : PF5, ClF3, XeF2 IF5, XeF4
молекула PF5 3S1 3p3 3d1 выравнивание P* PF5 валентность V гибридизация sp3d угол связи 1200,900,1800 форма молекулы треугольнаябипирамида
молекула ClF3 3S2 3p4 3d1 выравнивание Cl* ClF3 валентность III гибридизация sp3d угол связи 1200 форма молекулы плоский треугольник
молекула XeF2 5S2 5p5 5d1 выравнивание Xe* XeF2 валентность II гибридизация sp3d угол связи >1200 форма молекулы угловая
молекула IF5 5S2 5p3 5d2 выравнивание I* IF5 валентность V гибридизация sp3d2 угол связи 900,900 форма молекулы четырёхугольная пирамида
молекула XeF4 5S2 5p3 5d2 выравнивание Xe* XeF4 валентность IV гибридизация sp3d2 угол связи 900 форма молекулы плоский квадрат
Домашнее задание: §7 стр.58-64, упр.№1-4; Заполнить таблицу формулами веществ с различными типами гибридизации, в тетради привести доказательства определенных типов гибридизации. Подготовиться к самостоятельной работе.
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
Курс профессиональной переподготовки
Методическая работа в онлайн-образовании
Курс повышения квалификации
Современные педтехнологии в деятельности учителя
Ищем педагогов в команду «Инфоурок»
Другие типы гибридизации атомных орбиталей.
11 класс (профильный)
I. Организация начала. Актуализация знаний прошлого урока
1. Что такое орбиталь? Какие формы орбиталей вам известны? СЛАЙД 1
2. В курсе органической химии изучали понятие «гибридизация». Что оно означает? СЛАЙД 2.
3. причины гибридизации? СЛАЙД 3.
4. Какие виды гибридизации орбиталей вам известны?
5. Как определить тип гибридизации?
6. Какой тип химической связи ( σ или π ) является определяющим для геометрии молекулы? СЛАЙД 4
7. какова форма молекулы и угол связи в случае sp, sp2 и sp3 гибридизации орбиталей атома углерода в органических соединениях?
Индивидуальная работа учащихся у доски (3 учащихся), остальные работают в тетрадях.
II. Мотивация и целеполагание
Понятие гибридизации – универсальное, т.е. применимо и для молекул неорганических веществ (как простых, так и сложных). Наиболее склонны к гибридизации атомы II периода П.С.Х.Э.
Привести примеры молекул, не содержащих кратных связей, имеющих атом в sp, sp2 и sp3 гибридизации;
(в помощь учащимся учитель предлагает видеоматериал) СЛАЙДЫ 5-15
Учащиеся приводят примеры молекул неорганических и органических веществ
sp (BeF2)
sp3 (CH4, CCl4, SiH4, NH3, Н2О, HF и ионы NH4+, Н3О+)
Привести примеры молекул, содержащих кратные связи имеющие атомы в sp, sp2
sp (C2H2, CO2, N2O, HCN)
sp2 (C2H4, C6H6, SO2, NO2)
УПРАЖНЕНИЕ: СЛАЙД 17
Что общего у веществ молекулы, которых имеют состав: CO2 и SO2?
Валентность центрального атома IV. У углерода по одному электрону на четырёх орбиталях: одной s и трёх p.
У серы электроны располагаются два спаренных электрона на s-орбитали по одному на трёх p и одной d- орбиталях.
И у углерода, и у серы по две π-связи. Следовательно, у углерода в гибридизации не принимают участие две p-орбитали. У серы одна d и одна p орбитали.
Что различного у этих веществ?
СЛАЙД 19
Тип гибридизации (sp и sp2) и геометрия молекулы (линейная и угловая соответственно)
Тип гибридизации центрального атома в молекуле SO3. Форма молекулы?
Валентность серы VI, значит, электроны располагаются по одному на шести орбиталях: s, 3p, 2d;
у серы три π-связи, значит, две d и одна p орбитали в гибридизации не участвуют. Следовательно, гибридизация серы –sp2, молекула треугольная
Выводы: (какие факторы влияют на форму молекулы?)
1. число атомов в молекуле (число σ связей);
2. наличие неподеленных пар, которые не участвуют в образовании связей с другими атомами;
Мы рассмотрели типы гибридизации, связанные с выравниванием S и p орбиталей.
Какие ещё типы гибридизации могут быть?
Учащиеся высказывают свои предположения.
Учитель предлагает сформулировать цели и тему второй части урока.
1. Формулируют цели второй части занятия:
— Изучить другие типы гибридизации и влияние гибридизации на форму молекулы.
— Научиться применять их для решения задач и упражнений.
2. Записывают подзаголовок урока.
III. Изучение нового материала
Учитель предлагает учащимся посмотреть на ряд веществ:
SCl4; SF6; XeF6
Наблюдают и анализируют (соединения серы с валентностью IV и VI, в которых нет кратных связей.) Валентность ксенона VI нет кратных связей
Задает вопросы:
1. Что общего у этих веществ?
Все связи одинарные, простые.
2. Что различного у всех этих веществ?
3. Как будет изменяться тип гибридизации центрального атома от SCl4; SF6 к XeF6?
СЛАЙДЫ 24-26, 27-29, 30-32.
В тетрадях записывают распределение электронов. Определяют валентность центрального атома.
Называют новые понятия- sp3d, sp3d2, sp3d2.
Определяют углы связей
4. Определите геометрическую форму молекул.
С помощью набора моделей атомов, конструируют модели молекул.
Определяют геометрию молекул:
SCl4 тетраэдр, углы: 1200, 90°
SF6 четырёхугольная бипирамида, углы: 90°, 90°, 180°
XeF6 пятиугольная пирамида, углы: 72°, 90°
Тип гибридизации центрального атома в молекулах PF5; ClF3; XeF2?
СЛАЙДЫ 33-35, 36-38, 39-41.
сходство в типе гибридизации: sp3d,
различие в геометрии: треугольная бипирамида,
Какой тип гибридизации будет у IF5, XeF4
СЛАЙДЫ 42-44, 45-47.
Самостоятельная работа
Вывод: сходство в типе гибридизации: sp3d2,
различие в геометрии: четырёхугольная пирамида, плоский квадрат,
соответственно.
V. Домашнее задание
• §7 стр.58-64, упр.№1-4; СЛАЙД 48
• Заполнить таблицу формулами веществ с различными типами гибридизации, в тетради привести доказательства определенных типов гибридизации, (приложение 1).
• Подготовиться к самостоятельной работе.
Угол между связями
Чтобы определить тип гибридизации и форму химической частицы, поступают следующим образом:
· находят центральный атом и определяют число σ-связей (по числу концевых атомов);
· определяют степени окисления атомов в частице;
· составляют электронную конфигурацию центрального атома в нужной степени окисления;
· если это необходимо, проделывают то же самое для концевых атомов;
· изображают схему распределения валентных электронов центрального атома по орбиталям
· отмечают орбитали, участвующие в образовании связей с концевыми атомами;
· определяют тип гибридизации, учитывая все орбитали, участвующие в образовании связи, а также неподеленные электроны; если валентных орбиталей недостаточно, используют орбитали последующих энергетических уровней;
· по типу гибридизации определяют геометрию химической частицы.
· Наличие π-связей не влияет на тип гибридизации.
Задания для учащихся:
Каково пространственное строение и тип гибридизации в молекулах и ионах (запишите их формулы в таблицу):
Номер материала: 469423
Не нашли то что искали?
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Безлимитный доступ к занятиям с онлайн-репетиторами
Выгоднее, чем оплачивать каждое занятие отдельно
Бельгийский город будет платить детям виртуальные деньги за отказ от неэкологичного транспорта
Время чтения: 0 минут
Учителям предлагают 1,5 миллиона рублей за переезд в Златоуст
Время чтения: 1 минута
К 2024 году в каждой российской школе должен появиться спортивный клуб
Время чтения: 2 минуты
Детский омбудсмен предложила обучать педагогов мотивированию учащихся
Время чтения: 1 минута
Путин поручил не считать выплаты за классное руководство в средней зарплате
Время чтения: 1 минута
Учителя Кубани смогут получить миллион рублей на взнос по ипотеке
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.