чем опасна остаточная моча в мочевом пузыре у мужчин
Хроническая задержка мочи ( Ишурия )
Хроническая задержка мочи – это неспособность полностью опорожнять мочевой пузырь. Симптомы зависят от количества остаточной урины, представлены основным заболеванием. При объеме остаточной жидкости более 150-200 мл появляются жалобы на тяжесть внизу живота, частые позывы на мочеиспускание. Диагностика подразумевает УЗИ тазовых органов, уродинамические исследования, уретроцистоскопию. При неврологическом генезе обоснована КТ или МРТ головного и спинного мозга. Лабораторные тесты включают ОАМ, мазки, определение уровня ПСА, биохимию крови. Возможно консервативное (катетеризация, медикаментозная терапия) или оперативное лечение.
МКБ-10
Общие сведения
Задержку мочи (ишурию) чаще диагностируют у мужчин. У них заболеваемость составляет от 4,5 до 6,8 случаев на 1 000 человек и имеет тенденцию к росту по мере старения, что в 56% связано с прогрессированием ДГПЖ. У женщин данную патологию также регистрируют преимущественно в пожилом возрасте, уровень заболеваемости в 10 раз ниже. Распространенность хронической задержки мочи, вызванной неврологическими причинами, практически не зависит от пола. Диагностика и лечение хронической ишурии – прерогатива урологов, при фоновых болезнях нервной системы и позвоночника пациента дополнительно курирует невролог.
Причины
Хроническая ишурия может развиваться при целом ряде болезней и приеме некоторых медикаментов. Лечение трициклическими антидепрессантами вызывает мочевую задержку, уменьшая сокращение мышц детрузора. Симпатомиметики повышают тонус мочепузырной шейки и предстательной железы. Доказано, что некоторые антипаркинсонические, гипотензивные, антигистаминные лекарства, мышечные релаксанты и гормоны способствуют нарушению эвакуаторной функции органа. Основными предпосылками к развитию ишурии являются:
К способствующим хронической задержке урины факторам относят операции на органах малого таза. Определенную роль играют боль, травматизация, чрезмерное растяжение пузырных стенок и прием опиоидных препаратов. Спинальная анестезия чаще вызывает эвакуаторную дисфункцию по сравнению с селективной блокадой. К факторам риска относят осложненные роды с применением инструментальных способов родоразрешения, кесарево сечение.
Патогенез
Обструкция нижних мочевыводящих путей в области шейки мочевого пузыря или дистальнее вызывает ишурию. Препятствие может быть внутренним или внешним, но без лечения инфравезикальная обструкция всегда приводит к гипертрофии органа и сопровождается заменой мышечных структур соединительной тканью. Это выражается трабекулярностью стенки и формированием ложных дивертикулов. Страдает нервная регуляция, повышается тонус гладкомышечных клеток детрузора. Дальнейшее изменение гистоморфологической структуры ведет к декомпенсации, гипотонии и нарушению уродинамики.
При воспалительном этиологическом факторе основную роль отводят простатиту, который сопровождается отеком тканей предстательной железы. Нередко воспаление распространяется на соседние органы, что усугубляет состояние. Хроническая задержка мочи у неврологических больных обусловлена нарушением передачи импульсов от рецепторов пузыря к нервным центрам головного мозга и обратно. Большинство пациентов не полностью эвакуируют урину из-за гипорефлексии детрузора.
Симптомы
В отличие от острой задержки мочеиспускания для хронической патологии нехарактерен болевой синдром, основные клинические проявления могут выражаться симптомами основного заболевания. Типично ощущение неполного опорожнения, мочевыделение небольшими порциями, никтурия, необходимость натуживания. При длительно существующей задержке из-за постоянного переполнения органа может наблюдаться непроизвольное капельное выделение урины.
Меняется характер выделяемой мочи: застойная урина имеет неприятный запах, часто присутствует осадок, цвет жидкости насыщенный. При сильном натуживании сосуды, иннервирующие шейку, разрываются, что провоцирует гематурию. Ишурия может сопровождаться появлением крови в моче и при опухолевых процессах, но в этом случае чаще наблюдается выделение кровяных сгустков, чем равномерное окрашивание. Хроническая задержка мочи и повышение температуры свидетельствуют о развитии воспаления.
Осложнения
Длительный мочевой застой постепенно приводит к повышению внутрипузырного давления, из-за чего формируется патологический рефлюкс – заброс урины из пузыря обратно в мочеточники. Нарушается уродинамика верхних мочевыводящих путей, что вызывает гидронефроз. У возрастных пациентов, больных с гиперплазией простаты или полным выпадением матки в 25-50% случаев диагностируют рецидивирующий пиелонефрит и почечную недостаточность. У 70% хроническая задержка мочеиспускания без лечения переходит в острую.
Застойная жидкость является питательной средой для патогенных микроорганизмов. Ее температура оптимальна для их активного размножения, поэтому хронический вторичный цистит при ишурии встречается в 100% случаев. В концентрированной урине выпадают в осадок соли; они и слущенный эпителий, белок, лейкоциты, бактерии дают начало процессам цистолитиаза, что ведет к образованию камней. Перерастянутые стенки органа при травматизации больше подвержены разрыву, следствием чего может быть уриногенный перитонит, уросепсис.
Диагностика
Стандартный алгоритм диагностики отсутствует, уролог назначает обследование с учетом общей клинической картины. При физикальном осмотре над лобком может выделяться наполненный мочевой пузырь, при перкуссии звук тимпанический. Выраженная болезненность не обнаруживается. Пальцевое исследование прямой кишки позволяет оценить размер и консистенцию простаты, определить присутствие твердых каловых масс. Учитывая внушительный список препаратов, способствующих ишурии, необходимо уточнить, получает ли пациент какое-либо лечение. Диагностика включает:
Дифференциация проводится между заболеваниями, приведшими к задержке мочеиспускания. Для этого может потребоваться консультация гинеколога, проведение МРТ либо КТ органов малого таза при подозрении на рак простаты, осмотр онколога. Важно определить количество застойной жидкости, поскольку при объеме 150 мл в отсутствие симптомов лечение может быть консервативным (за исключением онкоурологии).
Лечение хронической задержки мочи
Лечение вариативно, зависит от причины, может включать медикаментозную и немедикаментозную терапию. У прооперированных пациентов с развившейся ишурией возможна установка катетера Фолея сроком на несколько дней. Неврологическим больным показана прерывистая катетеризация (выполняется по мере необходимости, при отсутствии позывов на мочевыделение – 3-4 раза в день). Проводится беседа о необходимости ухода за длительно функционирующими дренажами, что включает их ежедневное промывание антисептическими растворами, своевременную замену комплектующих.
Хирургическое лечение
При сопутствующем воспалении органов мочевыделения выполняют наложение эпицистостомы, поскольку постоянная катетеризация потенциально может привести к пролежню уретры, камнеобразованию, уросепсису. Дополнительно используют противомикробные средства. Эпицистостомия относится к паллиативным операциям, после стабилизации состояния при отсутствии тяжелой сопутствующей экстрагенитальной патологии могут быть выполнены оперативные вмешательства, в том числе малоинвазивные: ТУР, трансуретральная игольчатая абляция, инцизия, электровапоризация.
Лечение стриктуры уретры может быть оперативным, если бужирование было безуспешным, и задержка мочи не разрешилась. Участок сужения иссекается лазером или электроножом, в зависимости от расположения стриктуры и ее протяженности нередко применимо баллонное расширение, установка стента. Возрастным женщинам с пролапсом тазовых органов и хронической задержкой мочеиспускания выполняют удаление матки. Если к радикальному оперативному лечению имеются противопоказания, например, возраст старше 85 лет, запущенный рак, инфаркты и инсульты в анамнезе, останавливаются на троакарной эпицистостомии.
Прогноз и профилактика
Прогноз при хронической задержке мочи благоприятный в случае своевременной диагностики и раннего начала лечения. Неврологическим пациентам с ишурией прерывистая катетеризация позволяет сохранять приемлемый уровень жизни. Специалисты считают, что прием альфа-адреноблокаторов на фоне установленного катетера в некоторых случаях позволяет избежать операции, поскольку после удаления дренажа самостоятельное мочеиспускание восстанавливается, урина выделяется полностью.
Вероятность хронической задержки мочи при ДГПЖ снижается при приверженности больного длительной терапии (в течение 4-6 лет) до уменьшения объемов железы. Препараты, вызывающие ишурию, необходимо принимать по рекомендации и под контролем врача. Ежегодное посещение уролога обеспечивает раннее выявление и своевременное лечение ряда патологических процессов в урогенитальном тракте. Женщинам показаны регулярные профилактические осмотры гинеколога, отказ от подъема тяжестей; не стоит откладывать операцию по восстановлению анатомии тазовой области при пролапсе внутренних органов.
Лечение функциональных нарушений опорожнения мочевого пузыря
Лечение больных с функциональными нарушениями опорожнения мочевого пузыря является насущной проблемой нейроурологии. Это связано с тем, что до настоящего времени не разработано эффективных и этиопатогенетически обоснованных методов лечения таких больных
Лечение больных с функциональными нарушениями опорожнения мочевого пузыря является насущной проблемой нейроурологии. Это связано с тем, что до настоящего времени не разработано эффективных и этиопатогенетически обоснованных методов лечения таких больных.
Выделяют нейрогенные, миогенные (миопатии) и психогенные (неврозы, шизофрения, истерия и др.) факторы, лежащие в основе функциональных нарушений опорожнения мочевого пузыря. Нейрогенные нарушения и повреждения — основная причина таких нарушений. В отсутствие причины функциональных нарушений опорожнения мочевого пузыря следует думать об идиопатических формах заболевания.
Согласно классификации Международного общества по удержанию мочи, функциональные нарушения опорожнения мочевого пузыря — это результат недостаточной функции мочевого пузыря, гиперактивности уретры или следствие комплексного воздействия обоих нарушений [1]. Недостаточная функция мочевого пузыря возникает вследствие снижения или отсутствия сократительной способности детрузора (арефлексия), которые встречаются при локализации повреждения или неврологического поражения в области фронтальных долей и моста головного мозга, сакрального отдела спинного мозга, при повреждении волокон конского хвоста, тазового сплетения и нервов мочевого пузыря, а также при рассеянном склерозе. Гиперактивность уретры — это следствие наружной детрузорно-сфинктерной диссинергии (ДСД) или нерасслабляющегося (спастического) поперечно-полосатого (п/п) сфинктера уретры, также может проявиться как вариант синдрома Фоулера у женщин. При этом наружная ДСД наблюдается при супрасакральном уровне поражения спинного мозга.
В литературе имеются лишь единичные сообщения о распространенности функциональных нарушений опорожнения мочевого пузыря. Так, P. Klarskov и соавт., оценивая обращаемость в лечебные учреждения Копенгагена, выявили, что ненейрогенные формы нарушения опорожнения мочевого пузыря встречаются в среднем у 7 женщин на 100 000 населения [2]. По данным T. Tammela и соавт., после оперативных вмешательств на органах брюшной полости нарушения опорожнения мочевого пузыря встречаются у 2,9 % пациентов, а после проктологических операций — у 25% больных [3]. Многие авторы считают данную проблему особенно значимой у неврологических больных.
Клиническим проявлением снижения сократительной способности детрузора и нерасслабляющегося п/п сфинктера уретры являются симптомы нарушения опорожнения мочевого пузыря, к которым относятся затрудненное мочеиспускание тонкой, вялой струей, прерывистое мочеиспускание, необходимость прилагать усилия и натуживаться, чтобы начать мочеиспускание, ощущение неполного опорожнения мочевого пузыря.
При отсутствии сократительной способности детрузора в сочетании с паралитическим состоянием п/п сфинктера уретры больные опорожняют мочевой пузырь, искусственно увеличивая внутрибрюшное давление, что клинически проявляется мочеиспусканием слабой струей мочи. При отсутствии сократительной способности детрузора в сочетании со спастическим состоянием наружного сфинктера уретры в большинстве случаев самостоятельное мочеиспускание невозможно и отмечается хроническая задержка мочи.
Нерасслабляющийся п/п сфинктер уретры приводит к инфравезикальной обструкции с симптомами нарушения опорожнения мочевого пузыря.
Клинические проявления наружной ДСД (непроизвольное сокращение п/п сфинктера уретры во время мочеиспускания или непроизвольного сокращения детрузора) включают два вида симптомов, а именно: нарушения опорожнения и накопления мочи в мочевом пузыре. Последние включают учащенное и ургентное мочеиспускание нередко в сочетании с ургентным недержанием мочи и никтурией. Для наружной ДСД характерно неполное опорожнение мочевого пузыря и развитие пузырно-мочеточникового рефлюкса.
Таким образом, различные формы нарушения опорожнения мочевого пузыря могут иметь во многом сходную клиническую картину. В связи с этим правильная и своевременная диагностика функциональных нарушений опорожнения мочевого пузыря является залогом успешного лечения.
Диагностика функциональных нарушений опорожнения мочевого пузыря складывается из сбора жалоб и анамнеза, урологического и неврологического обследования, а также дополнительных методов обследования, среди которых основное место занимает уродинамическое исследование. На начальном этапе обследования обязательна оценка симптомов нижних мочевых путей на основании вопросника I-PSS (Internanional Prostate Symptom Score). Вопросник I-PSS был предложен для оценки нарушений акта мочеиспускания вследствие заболеваний предстательной железы, однако в настоящее время он с успехом применяется и в случаях проявления симптомов заболеваний нижних мочевых путей, вызванных различными факторами, в том числе и неврологического характера.
Для уточнения поведения детрузора и его сфинктеров в фазу опорожнения мочевого пузыря наиболее информативным методом исследования больных является комплексное уродинамическое исследование.
Уродинамическими признаками наружной ДСД, характерной для надкрестцовой локализации патологического процесса, особенно в шейном отделе спинного мозга, являются регистрируемые с помощью электромиографии во время мочеиспускания «всплески» сократительной активности п/п сфинктера уретры и мышц тазового дна. Сокращение мышц тазового дна затрудняет или полностью прерывает поток мочи. Для нерасслабляющегося сфинктера уретры характерно отсутствие снижения электромиографической активности п/п сфинктера уретры во время мочеиспускания. Снижение или отсутствие сократительной способности детрузора уродинамически проявляется отсутствием плавного повышения детрузорного давления в ходе цистометрии или отсутствием позыва к акту мочеиспускания.
Следует подчеркнуть, что только уродинамическое обследование дает возможность достоверно установить форму нарушения функции нижних мочевых путей, приводящих к нарушению опорожнения мочевого пузыря, и во многом определить выбор метода лечения.
Ультразвуковое исследование почек и мочевого пузыря, также как и экскреторная урография, позволяет уточнить анатомическое состояние верхних мочевых путей и количество остаточной мочи в мочевом пузыре. По количеству остаточной мочи в мочевом пузыре после акта мочеиспускания (в норме до 50 мл) можно косвенно судить о функциональном состоянии детрузора и наличии инфравезикальной обструкции.
В таблице перечислены методы лечения больных с функциональными нарушениями опорожнения мочевого пузыря, из которых только медикаментозная терапия и дорзальная ризотомия с электростимуляцией передних корешков могут действительно считаться методами лечения, тогда как другие скорее являются способами опорожнения мочевого пузыря. При этом даже медикаментозная терапия во многом является симптоматическим методом лечения. Несмотря на это, назначение лекарственных средств представляет собой первый этап лечения больных с функциональными нарушениями опорожнения мочевого пузыря. Выбор медикаментов зависит от вида нарушения функции нижних мочевых путей. Так, в случае нарушения сократительной способности детрузора применяют антихолинэстеразные средства и М-холиномиметики, а при гиперактивности уретры — центральные миорелаксанты и α-блокаторы.
У 22 больных со сниженной сократительной способностью детрузора использовали дистигмина бромид (убретид) в дозе 5 мг через день за 30 мин до завтрака в течение 2 мес. При этом через каждые 2 нед делали 7-дневный перерыв в приеме препарата. Механизм действия дистигмина бромида заключается в блокировании ацетилхолинэстеразы, что сопровождается увеличением концентрации ацетилхолина в синаптической щели и соответственно приводит к облегчению передачи нервного импульса.
У всех больных терапевтический эффект развивался в первую неделю приема препарата и выражался в снижении среднего балла I-PSS c 15,9 до 11,3, а количества остаточной мочи — с 82,6 до 54,3 мл. Субъективно пациенты отмечали усиление ощущения позыва и облегчение начала акта мочеиспускания.
Следует отметить, что до настоящего времени остается открытым вопрос о продолжительности лечения антихолинэстеразными средствами. По нашим данным, у 82% больных в разные сроки после окончания 2-месячного курса лечения отмечалось возобновление симптомов, потребовавшее повторного назначения препарата.
К сожалению, мы не накопили собственного опыта применения бетанехола у больных со сниженной сократительной способностью детрузора, так как данный препарат не зарегистрирован для клинического применения в нашей стране и соответственно отсутствует в аптечной сети. Механизм действия бетанехола аналогичен действию ацетилхолина на гладкие миоциты. Данные других авторов показывают, что бетанехол может применяться при лечении больных с легкой степенью нарушения сократительной способности детрузора [4, 5].
α1-адреноблокатор доксазозин (кардура) использовали в ходе лечения 30 больных с гиперактивностью уретры, в том числе 14 пациентов с наружной ДСД и 16 с нарушением произвольного расслабления п/п сфинктера уретры. Доксазозин назначали в дозе 2 мг/сут на ночь.
Через 6 мес средний балл по шкале I-PSS у больных с наружной ДСД снизился с 22,6 до 11,4, количество остаточной мочи уменьшилось с 92,6 до 32,4 мл, а максимальная скорость потока мочи увеличилась с 12,4 до 16,0 мл/сек.
Кроме того, через 6 мес у больных с нарушением произвольного расслабления п/п сфинктера уретры средний балл I-PSS снизился с 14,6 до 11,2, количество остаточной мочи — с 73,5 до 46,2 мл, а максимальная скорость потока мочи увеличилась с 15,7 до 18,4 мл/сек.
Баклофен и тизанидин (сирдалуд) являются центральными миорелаксантами. Они снижают возбуждение моторных нейронов и интернейронов и могут ингибировать передачу нервного импульса в спинном мозге, уменьшая спастичность п/п мышц. По нашим данным, после применения баклофена в дозе 20 мг/сут и тизанидина в дозе 4 мг/сут не было выявлено существенной динамики субъективных и объективных симптомов как у больных с наружной ДСД, так и у пациентов с нарушением расслабления п/п сфинктера уретры. Выраженная слабость мускулатуры конечностей на фоне приема этих препаратов не позволяет увеличивать дозу препаратов, что существенно ограничивает их применение в клинической практике.
Следует отметить, что медикаментозная терапия эффективна у больных с начальными и легкими формами нарушения опорожнения мочевого пузыря. Тем не менее ее целесообразно использовать в качестве первого этапа лечения. В случае недостаточной эффективности медикаментозной терапии необходимо искать новые пути решения проблемы адекватного опорожнения мочевого пузыря.
Предложенная Lapides и соавт. в 80-е гг. прошлого столетия интермиттирующая аутокатетеризация мочевого пузыря до настоящего времени остается одним из основных методов опорожнения мочевого пузыря [6]. Однако этот метод имеет ряд осложнений, к которым относятся инфекции нижних мочевых путей, стриктуры уретры и, самое главное, значительное снижение качества жизни. При невозможности выполнения (неврологические больные с тетраплегией, больные с ожирением) или отказе пациента от аутокатетеризации, у лиц с наружной ДСД и нерасслабляющимся сфинктером уретры, а также со сниженной сократительной способностью детрузора для адекватного опорожнения мочевого пузыря применяют в последние годы имплантацию специальных стентов (производства фирм Balton, Mentor, МедCил) и инъекции ботулинического токсина в зону п/п сфинктера уретры.
 |
| Рисунок 1. Временный уретральный стент |
Временные уретральные стенты имеют форму цилиндра, выполненного из проволочной спирали толщиной 1,1 мм, изготовлены они на основе полимолочной и полигликоликовой кислот с различным периодом разрушения (от 3 до 9 мес) посредством гидролиза (рис. 1). Механические свойства и время разрушения временных стентов зависят от степени поляризации, места и формы зоны имплантации.
Мы имеем опыт применения временных уретральных стентов у семи мужчин с наружной ДСД и у четырех пациентов, у которых отсутствовала сократительная способность детрузора. Временный уретральный стент устанавливали при уретроцистоскопии таким образом, чтобы он «шинировал» как простатический, так и мембранозный отделы уретры. Такое положение стента обеспечивает адекватное опорожнение мочевого пузыря.
У всех больных отмечалось восстановление самостоятельного мочеиспускания сразу после имплантации уретрального стента. Пациенты с наружной ДСД осуществляли мочеиспускание по позыву, а больные с отсутствием сократительной способности детрузора с интервалом 4 ч (6 раз в сутки) с использованием приема Креда. По данным ультразвукового сканирования, через 10 нед после установки стента у больных с наружной ДСД не отмечалось остаточной мочи, а у больных с отсутствием сократительной способности детрузора среднее количество остаточной мочи составило 48 мл и зависело от адекватности выполнения приема Креда. Очень важно, что у больных с наружной ДСД было выявлено снижение максимального детрузорного давления во время мочеиспускания в среднем с 72 до 35 см вод. ст. (профилактика развития пузырно-мочеточникового рефлюкса).
Мы считаем, что временные уретральные стенты обеспечивают адекватное опорожнение мочевого пузыря и показаны тем больным с нарушением опорожнения мочевого пузыря, которым не может быть выполнена интермиттирующая катетеризация мочевого пузыря или которые воздерживаются от нее по различным причинам. Временные стенты могут являться методом отбора больных для установки постоянных (металлических) стентов.
В последние годы в литературе появились сообщения об успешном использовании ботулинического токсина у больных с функциональными нарушениями опорожнения мочевого пузыря. В нашей клинике ботулинический токсин применялся у 16 больных с нарушением опорожнения мочевого пузыря, в том числе у девяти с наружной ДСД, у трех с нерасслабляющимся п/п сфинктером уретры и у четырех с нарушением сократительной способности детрузора. Мы использовали ботулинический токсин типа А фармацевтической фирмы Allergan. Коммерческое название препарата — ботокс (Botox), он представляет собой лиофилизированный порошок белого цвета в вакуумных стеклянных флаконах объемом 10 мл, закрытых резиновой пробкой и герметичным алюминиевым затвором. В одном флаконе содержится 100 ЕД ботулинического токсина типа А.
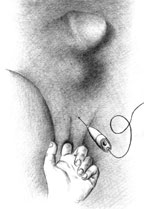 |
| Рисунок 2. Введение ботулинического токсина у мужчин |
Механизм действия ботокса заключается в блокировании выброса ацетилхолина из пресинаптической мембраны в нервно-мышечном синапсе. Фармакологическим эффектом этого процесса является стойкая хемоденервация, а клиническим проявлением — расслабление мышечных структур.
Согласно рекомендациям фирмы-производителя, лиофилизированный порошок разводили 8 мл стерильного 0,9% раствора натрия хлорида без консервантов (1 мл полученного раствора содержит 12,5 ЕД ботокса). Использовали трансперинеальную методику введения препарата. У мужчин под контролем указательного пальца, введенного в прямую кишку, специальную иглу с изоляционным покрытием вводили в точку, находящуюся на 2 см латеральнее и выше анального отверстия (рис. 2). У женщин иглу под контролем указательного пальца, введенного во влагалище, вводили в точку на 1 см латеральнее и выше наружного отверстия уретры на глубину 1,5–2,0 см (рис. 3). Во всех случаях положение иглы контролировали электромиографически по характерному звуку динамика электромиографа. В каждую точку вводили по 50 ЕД ботокса.
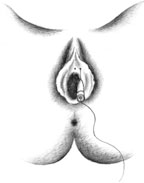 |
| Рисунок 3. Введение ботулинического токсина у женщин |
У всех больных через 10 дней после введения ботулинического токсина исчезла остаточная моча и было отмечено увеличение максимальной скорости потока мочи. Важно, что хемоденервация сфинктера уретры после инъекции ботокса у всех пациентов с нерасслабляющимся п/п сфинктером и наружной ДСД приводила к снижению детрузорного давления, а у больных с нарушением сократительной способности детрузора — к снижению максимального абдоминального давления, вызывающего выделение мочи из наружного отверстия уретры. Это наблюдение представляется крайне важным в отношении профилактики развития пузырно-мочеточникового рефлюкса и сохранения функциональной способности почек. Только у одного больного клинический эффект после инъекции ботокса продолжал сохраняться на протяжении 16 мес, остальным пациентам потребовались повторные инъекции препарата с периодичностью 3–8 мес.
В отдельных случаях, при выраженной инвалидизации больных с нарушением опорожнения мочевого пузыря, используют трансуретральную инцизию или резекцию наружного сфинктера уретры, дренируют мочевой пузырь постоянным уретральным катетером или выполняют цистостомию.
Таким образом, нарушение опорожнения мочевого пузыря может быть следствием различных форм дисфункции нижних мочевых путей. Требуются проведение комплексного уродинамического обследования для уточнения функционального состояния мочевого пузыря и его сфинктеров и выбор адекватного метода опорожнения мочевого пузыря. Отсутствие высокоэффективных и универсальных способов лечения больных с функциональными нарушениями опорожнения мочевого пузыря диктует необходимость поиска новых методов терапии таких больных.
Г. Г. Кривобородов, доктор медицинских наук
М. Е. Школьников, кандидат медицинских наук
РГМУ, Москва