Фосфолипаза с что делает
Фосфолипаза с что делает
Активация мембранной гуанилатциклазы происходит не под непосредственным влиянием гормон-рецепторного комплекса, а опосредованно через ионизированный кальций и ок-сидантные системы мембран. Определяющая эффекты ацетилхолина стимуляция активности гуанилатциклазы также осуществляется опосредованно через Са2+. Через активацию гуанилатциклазы реализует эффект и на-трийуретический гормон предсердий — атриопептид. Путем активации пе-рекисного окисления стимулирует гуанилатциклазу гормон эндотелия сосудистой стенки оксид азота — расслабляющий эндотелиальный фактор. Под влиянием гуанилатциклазы из ГТФ синтезируется цГМФ, активирующий цГМФ-зависимые протеинкиназы, которые уменьшают скорость фосфорилирования легких цепей миозина в гладких мышцах стенок сосудов, приводя к их расслаблению. В большинстве тканей биохимические и физиологические эффекты цАМФ и цГМФ противоположны. Примерами могут служить стимуляция сокращений сердца под влиянием цАМФ и торможение их цГМФ, стимуляция сокращения гладких мышц кишечника цГМФ и подавление цАМФ. цГМФ обеспечивает гиперполяризацию рецепторов сетчатки глаза под влиянием фотонов света. Ферментативный гидролиз цГМФ, а следовательно, и прекращение гормонального эффекта, осуществляется с помощью специфической фосфодиэстеразы.
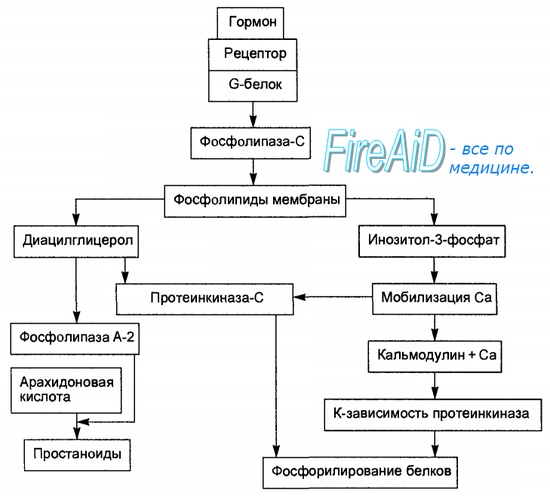
Образование гормон-рецепторного комплекса при участии регуляторного G-белка активирует мембранную фосфолипазу С, вызывающую гидролиз фосфолипидов мембраны с образованием двух вторичных посредников: инозитол-3-фосфата и диацилглицерола. Инозитол-3-фосфат ведет к выходу Са2+ из внутриклеточных депо. Связывание ионизированного кальция со специализированным белком кальмодулином активирует протеинкиназы и вызывает фосфорили-рование внутриклеточных структурных белков и ферментов. Диацилглицерол повышает сродство протеинкиназы С к Са2+, способствуя ее активации, что также завершается процессами фосфорилирования белков. Диацилглицерол одновременно реализует другой путь опосредования гормонального эффекта, активируя фосфолипазу А-2 и образование простаноидов.
Система фосфолипаза С — инозитол-3-фосфат.
Гормонрецепторный комплекс с участием регуляторного G-белка ведет к активации мембранного фермента фосфолипазы С, вызывающей гидролиз фосфоли-пидов мембраны с образованием двух вторичных посредников: инозитол-3-фосфата и диацилглицерола. Инозитол-3-фосфат вызывает выход Са2+ из внутриклеточных депо, в основном из эндоплазматического ретикулума, ионизированный кальций связывается со специализированным белком кальмодулином, что обеспечивает активацию протеинкиназ и фосфорили-рование внутриклеточных структурных белков и ферментов. В свою очередь диацилглицерол способствует резкому повышению сродства протеинкиназы С к ионизированному кальцию, последний без участия кальмоду-лина ее активирует, что также завершается процессами фосфорилирования белков. Диацилглицерол одновременно реализует и другой путь опосредования гормонального эффекта за счет активирования фосфолипазы А-2. Под влиянием последней из мембранных фосфолипидов образуется арахи-доновая кислота, являющаяся источником мощных по метаболическим и физиологическим эффектам веществ — простагландинов и лейкотриенов. В разных клетках организма превалирует один или другой путь образования вторичных посредников, что в конечном счете и определяет физиологический эффект гормона. Через рассмотренную систему вторичных посредников реализуются эффекты адреналина (при связи с альфа-адренорецепто-ром), вазопрессина (при связи с V-1-рецептором), ангиотензина-И, соматостатина, окситоцина.
Исследование функциональных свойств ферментного препарата фосфолипазы С
Исследование функциональных свойств ферментного препарата фосфолипазы С
УДК 665.3.093.4
Волошенко С.В., младший научный сотрудник
Украинский научно-исследовательский институт масел и жиров Национальной академии аграрных наук Украины, г. Харьков
Гладкий Ф.Ф., д-р техн. наук, профессор
Национальный технический университет «Харьковский политехнический институт», г. Харьков
В статье сформулирована задача исследования функциональных свойств ферментного препарата отечественного производства, в состав которого входит фосфолипаза С., для проведения реакции ферментной гидратации растительных масле с целью создания экологически чистой технологии.
In the article for the purpose of creation the new ecologically pure technology the problem of research the functional properties of the enzyme preparation of domestic production, which consist phospholipase C, for reaction of enzeme degumming vegetable oils formulated.
На сегодняшний день в мире ферментнные технологии применяют в хлебопечении, в кондитерской промышленности, в приготовлении напитков, в производстве масел и жиров, а именно в производстве специальных жиров, косметических препаратов, гидратации масел и переэтерификации жиров [1].
Одними из основных ферментов, которые катализируют биохимические реакции в превращениях фосфолипидов, являются фосфолипазы.
В процессе рафинации растительных масле на этапе их гидратации с успехом внедрены в промышленность технологии, которые предусматривают использование ферментных препаратов, содержащих фосфолипазы А1 и А2.
Согласно литературным данным, а также на основании исследований, проведённых в Украинском научно-исследовательском институте масле и жиров Национальной академии аграрных наук Украины, на сегодняшний день уже доказана возможность использования фосфолипазы С отечественного производства в технологии гидратации растительных масел [2].
На данный момент в работе использовался ферментный препарат производства ЗАО «Энзим» фосфолипаза С с низкой активностью, которая составляет 500 ед/г. Для продолжения исследований в 2011 году в г. Ладыжин на предприятии «Энзим» был синтезирован ферментный препарат фосфолипаза С активностью 14394 ед/г.
Таким образом, целью научно-исследовательской работы является изучение функциональных свойств данного ферментного препарата фосфолипазы С отечественного производства, т.е. способность его ускорять гидролиз фосфолипидов, для создания новой экономичной и экологически чистой технологии гидратации растительных масел.
Для достижения цели исследований необходимо решение следующих задач: проведение реакции пробной гидратации растительных масел с использованием ферментного препарата, в состав которого входит фосфолипаза С и определение качественных показателей гидратированного масла и фосфоросодержащего осадка.
Результаты исследований представлены на рис. 1,2,3 и в таблице 1.

Рис. 1 — Зависимость кислотного числа масла от температуры реакции ферментной гидратации, проведенной с использованием ферментного препарата фосфолипазы С
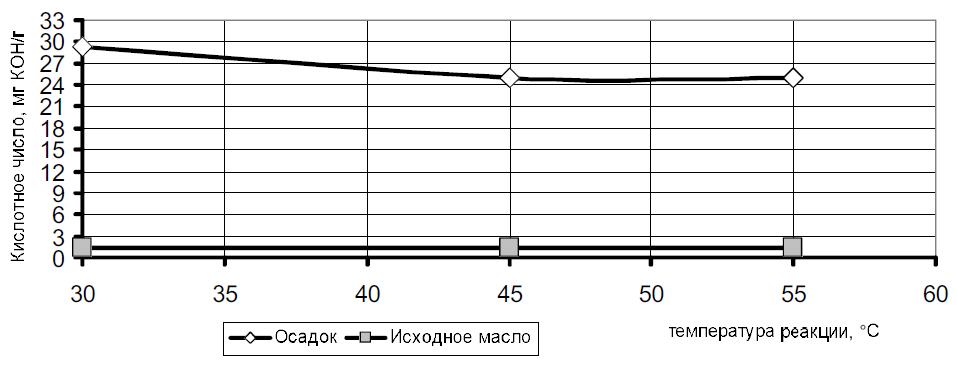
Рис. 2 — Зависимость кислотного числа фосфоросодержащего осадка от температуры реакции ферментной гидратации, проведенной с использованием ферментного препарата фосфолипазы С.
В результате исследования влияния температуры реакции на изменение кислотного числа гидратированного масла и образовавшегося фосфоросодержащего осадка, установлено, что в масле происходит уменьшение кислотного числа по сравнению с исходным продуктом в выбранном температурном интервале. В свою очередь в фосфоросодержащем осадке наблюдается резкое увеличение кислотного числа при температуре реакции 30 o C и незначительное его снижение при температурах реакции 45 — 55 o C, что может свидетельствовать о том, что в осадке накапливаются свободные кислоты, образовавшиеся в процессе ферментной гидратации.

Рис. 3 — Зависимость массовой доли фосфоросодержащих веществ масла от температуры реакции ферментной гидратации, проведенной с использованием ферментного препарата фосфолипазы С
Как видно из рис. 3, снижение массовой доли фосфоросодержащих веществ происходит до 0,15 %. Следовательно, для полного выведения фосфолипидов из масла необходимо использовать ещё дополнительные методы очистки или другие ферментные препараты.
Таблица 1 — Результаты исследований массовой доли МАГ, ДАГ и ТАГ в продуктах реакции ферментной гидратации с использованием фосфолипазы С
| Наименование продукта | Массовая доля МАГ, % | Массовая доля ДАГ, % | Массовая доля ТАГ, % |
| Исходное масло | 1,280 | 2,348 | 96,373 |
| Масло гидратированное при t 30 o C | 1,284 | 1,974 | 96,741 |
| Масло гидратированное при t 45 o C | 1,259 | 2,131 | 96,610 |
| Масло гидратированное при t 55 o C | 1,272 | 1,959 | 96,769 |
Выводы
Всё вышесказанное может свидетельствовать о том, что фосфолипаза С производства ЗАО «Энзим» действует только на определённые группы фосфолипидов (на какие именно — будет установлено впоследствии); также на основании проанализированных данных можно предположить, что данная фосфолипаза имеет механизм действия фосфолипазы А1 или А2. Также имеется вероятность того, что данный ферментный препарат вообще не проявляет специфической активности фосфолипазы С и реакция идёт по механизму обычной водной гидратации, поскольку использование этого ферментного препарата предусматривает добавление 1-2 % воды в среду реакции.
Литература
1.Ключникова Л. В. Ферментные технологии — будущее масложировой промышленности // Масложировая промышленность. — 2006. — № 4. — с. 30 — 31.
2. Волошенко С. В. Новая технология ферментной гидратации фосфолипидов растительных масел // Масложировой комплекс. — 2011. — № 2. — с. 35 — 36.
Перекисное окисление липидов и активность липопротеин-ассоциированной фосфолипазы А2 в сыворотке крови у больных неалкогольной жировой болезнью печени
Опубликовано в журнале:
« Поликлиника » 4/2015 Л.А. Звенигородская, Т.В. Нилова, А.В. Петраков, МКНЦ (ЦНИИГ), Москва
Ключевые слова: неалкогольная жировая болезнь печени, малоновый диальдегид фосфолипаза А2,оксид азота, эндотоксин.
Цель настоящего исследования – определить уровень малонового диальдегида (МДА) у больных НАЖБП в сыворотке крови и его связь с повреждением мембран гепатоцитов в зависимости от морфологической картины заболевания. Выявить взаимосвязь перекисного и фосфолипазного механизма повреждения мембран гепатоцитов с другими маркерами воспаления эндотоксином и оксидом азота.
Материалы и методы исследования
Содержание ФЛА2 определяли иммуноферментным методом с помощью диагностических наборов PLAC TEST Elisa Kit(CША). Метод позволяет провести измерение белка секретируемой ФЛА2 при использовании высокоспецифичных моноклональных антител. ПОЛ определяли по содержанию МДА с тиобарбитуровой кислотой. [1] Для определения эндотоксина применяли хромогенный метод по конечной точке с использованием ЛАЛ теста (Limulus amebocyte lysate, США). Уровень метаболитов оксида азота определяли скрининг-методом в биологических жидкостях как маркер дисфункции эндотелия с хлоридом ванадия (Германия). [11] Статистическую обработку данных провели с использованием программ «Биостат» и Статистика.
Введение
Свободнорадикальные реакции ПОЛ протекают во всех клетках и тканях живых организмов, в основном в биомембранах, и представляют собой каскад окислительных реакций деградации ненасыщенных жирных кислот, входящих в состав фосфолипидов. В клетках здорового организма уровень ПОЛ является жизненно важным звеном в регуляции проницаемости и транспорта веществ через мембраны, в синтезе простагландинов, метаболизме стероидных гормонов и других клеточных механизмах. [3]
Окислительные реакции с участием свободных радикалов рассматриваются в настоящее время как необходимый процесс в регуляции клеточного метаболизма. Особо важное значение ПОЛ для организма заключается в обновлении мембран клеток. При нарушении структуры и функции клеточной мембраны изменяется концентрация ионов по обе стороны мембраны, повреждаются функции сигнальных и транспортных систем. Это приводит к развитию инсулинорезистентности.
Полиненасыщенные жирные кислоты (ПНЖК) являются субстратами для синтеза простагландинов. Избыток кальция активирует фосфолипазу А2, что отражается на структуре фосфолипидов, в митохондриях уменьшается содержание фосфатидилхолина и фосфатидилэтаноламина. При активации фосфолипаз из фосфолипидов высвобождаются ПНЖК и легко окисляются.
Окисление ПНЖК с образованием эндоперекисей может происходить в процессе ПОЛ, которое необходимо для синтеза лейкотриенов, регуляции липидного состава мембран, метаболизма катехоламинов и фагоцитоза. Стационарный уровень протекания ПОЛ регулируется антиоксидантной системой, которая ограничивает образование липидных радикалов.
Супероксиддисмутаза, каталаза и глутатионзависимые ферменты сохраняют клетки от окислительного стресса. Активность ферментов антиоксидантной защиты снижалась при воспалении, а активация фосфолипазы увеличивалась. [5] Ингибировать глутатионзависимые ферменты могут продукты фосфолипазного гидролиза – свободные жирные кислоты. Важную роль в антиоксидантной защите организма играют пептиды, в состав которых входят SH-содержащие аминокислоты: цистеин, цистин и метионин. Особое место занимает глутатион, образованный аминокислотами цистеином, глицином и глутаминовой кислотой. SH-содержащие соединения защищают клетки от повреждающего действия свободных радикалов. Дефицит холина и метионина способствует угнетению фермента cтеаторил-коэнзим А-десатураза-1 (SСД-1), которая катализирует десатурацию пальмитиновой и стеариновой кислот, регулирует запасы ТГ в клетке и проявляет защитное действие на клетки печени. Низкая активность SСД-1 усугубляет тяжесть течения стеатогепатита. [19]
В качестве основных механизмов перехода от стеатоза к стеатогепатиту рассматривают ускоренный липолиз, аккумуляцию липидов в гепатоцитах, оксидативный стресс с формированием избытка свободных радикалов, повреждение ДНК и некроз гепатоцитов.
При стеатогепатите морфологические изменения характеризуются формированием гигантских митохондрий, что ведет к апоптозу клеток. Воспалительная реакция представлена внутридольковыми инфильтратами на фоне жировой дистрофии гепатоцитов. Также наблюдаются жировые кисты, «пустые» ядра гепатоцитов, липогранулемы. [2]
Воспалительная реакция начинается с эндотелия. При воспалении, гипоксии, эндотоксиновой агрессии происходит нарушение функции эндотелия. Макрофаги под действием эндотоксина выделяют оксид азота, который легко проникает в клетки и взаимодействует с ферментами и белками. Оксид азота ингибирует калий-натрий-АТФ-азу, тем самым снижается чувствительность к инсулину, ингибируются митохондриальные ферменты, цитохром-Р-450, который метаболизирует жирные кислоты и холестерин, происходит накопление СЖК в клетках печени. В условиях гипергликемии усиливаются процессы ПОЛ, что может индуцировать апоптоз, за счет активации ядерного фактора транскрипции, повышающего экспрессию индуцибельной синтазы оксида азота. [8,20]
Влияние ЛПС и других медиаторов воспаления на функцию печени вызывает экспрессию синтеза фосфолипазы А2 и усиление жировой инфильтрации печени. Усиление гепатоцитами и клетками эндотелия синтеза ФЛА2 формирует воспалительный процесс.
Липопротеин-ассоциированная фосфолипаза А2 (ФЛА2) гидролизует фосфолипиды в ЛПВП и ЛПНП в кровотоке. В результате гидролиза образуется лизо-фосфатидилхолин (лизо-ФХ) – активный провоспа-лительный липид, который стимулирует образование активных форм кислорода нейтрофилами, клетками эндотелия и макрофагами в интиме артерий. Лизо-ФХ также изменяет активность синтазы оксида азота и количество синтезируемого NO.
Лизо-ФХ играет ключевую роль в атерогенезе, являясь цитотоксичным к клеткам сосудов, резко изменяет текучесть мембран, способствует высвобождению медиаторов воспаления, также изменяет активность синтазы оксида азота и количество синтезируемого NO.
Происходит нарушение эндотелий зависимой ва-зодилатации за счет снижения биодоступности оксида азота для гладкомышечных клеток артериол. [14] Липо-литический фермент ФЛА2 проявляет свою активность в клетках печени. Особое значение имеет фосфолипаз-ная активность митохондрий, которая играет ведущую роль в развитии некротических изменений в клетке.
Результаты исследования и их обсуждение
Верхней границей физиологического уровня принято считать 200 нг/мл. У больных НАЖБП в стадии стеатогепатита (НАСГ) содержание ФЛА2 у 33 больных (40%) было повышено в 3,8 раза (медиана 199,7–528,2 нг/мл) и составило 493,6±81,93 нг/мл. У 22 больных из них высокий риск сердечно-сосудистых осложнений (медиана 324,3–764,4), в среднем 488,9±25,86 нг/мл. ФЛА, мг/мл
Рис. 1а. Содержание ФЛА у больных НАЖБП
Рис. 1б. Корреляционное соотношение ФЛА2 с ЛПНП
При попадании в кровоток ФЛА2 связывается и транспортируется с ЛПНП, отмечена тесная корреляционная связь ФЛА2 с ЛПНП (r=0,957). Р2 у 47 больных (60%) в среднем 129,7±6,22 нг/ мл. Активность фермента в плазме и тканях регулируется индукцией цитокинов и бактериальных токсинов и коррелирует со степенью развития патологических процессов при различных заболеваниях.
У 65 больных НАЖБП в стадии НАСГ было определено в сыворотке крови содержание МДА и ФЛА2. Содержание МДА у этих больных было увеличено в 2 раза и составило в среднем 18,81 ±1,24 мкмоль/л, в контроле 9,94±1,62 мкмоль/л. МДА мкмоль/л
Рис. 2а. Перекисное окисление липидов (ПОЛ).
Содержание малонового диальдегида (МДА) у больных НАЖБП
Рис. 2б. Корреляция ФЛА2-МДА
Отмечен высокий уровень ФЛА2 (640 нг/мл) и МДА (15,98 мкмоль/л) у 26 больных НАСГ и низкий уровень ФЛА2 при нормальном содержании МДА у остальных больных НАЖБП. и МДА находятся в отрицательной корреляционной зависимости, коэффициент корреляции –0,578.
Рис. 3а. Содержание ФЛА2 в сыворотке крови у больных НАЖБП
Рис. 3б. Содержание МДА в сыворотке крови у больных НАЖБП
Рис. 3в. Корреляционное соотношение между ФЛА2 и МДА
При чрезмерном накоплении липидов в гепатоцитах усиливаются процессы ПОЛ, что ведет к некрозу гепатоцитов, нарушению функций митохондрий, постепенному развитию фиброза печени и формированию стеатогепатита.
Сравнительный анализ содержания стабильных метаболитов оксида азота в сыворотке крови больных и контрольной группы показал, что воспалительный процесс в группе стеатогепатита достоверно сопровождался повышенной продукцией оксида азота. Уровень метаболитов возрастал параллельно концентрации аминотрансфераз. Отмечена корреляционная зависимость оксида азота и аланиновой трансаминазой (АЛТ) r=0,86 Р=0,001). Уровень ФЛА2 возрастал при воспалении у больных НАСГ и коррелировал с уровнем оксида азота (r=0,62 Р=0,001).
Рис. 4. Морфология. Жировая инфильтрация гепатоцитов при стеатозе печени
Рис. 5. Морфология. Смешанноклеточный внутридольковый инфильтрат при стеатогепатите
Рис. 6. Морфология. Фагоцитарные гранулемы и перигепатоцеллюлярный фиброз при стеатогепатите
У больных с висцеральным ожирением и инсулинорезистентностью усиление оксидативного стресса приводит к инактивации NO за счет накопления реактивных кислородных радикалов. Нарушается равновесие в системе NO в сторону увеличения концентрации сосудосуживающих факторов и снижении биодоступности NO. Повреждение эндотелия сосудов усугубляется воздействием окисленных форм ЛПНП.
Обильный рост патогенной микрофлоры вызывает формирование бактериального воспаления в слизистой оболочке тонкой кишки, что вызывает активацию процессов ПОЛ.
Содержание эндотоксина в сыворотке крови было повышено у больных НАСГ по сравнению с контролем и больными стеатозом печени. При попадании ЛПС в системный кровоток он связывается с белком и запускает каскад иммунных реакций. Эндотоксемия определяется как циркуляция в крови бактериальных эндотоксинов в концентрации выше 2,5 ЕЭ. [10]
Отмечена корреляционная связь между содержанием эндотоксина и оксида азота (r=0,62, Р=0,001). Повышение эндотоксина и оксида азота выявлено при прогрессировании воспалительной инфильтрации в печени, что доказывает участие маркеров воспаления в патогенезе НАЖБП.
При НАЖБП маркеры воспаления были повышены при воспалительной стадии перехода стеатоза к стеатогепатиту параллельно повышению печеночных ферментов и морфологической картине воспалительной инфильтрации в печени.
НАЖБП часто ассоциируется с метаболическими нарушениями: повышенной массой тела, дислипидемией, сердечно-сосудистыми заболеваниями, сахарным диабетом типа 2.
В настоящее время для лечения больных НАЖБП используют препараты, сочетающие в себе антиоксидантную защиту, стабилизацию мембран гепатоцитов, противовоспалительную терапию. Получены убедительные данные о влиянии препарата Дибикор на углеводный и жировой обмен при НАЖБП. Дибикор – лекарственный препарат (ПИК-ФАРМА, Россия), действующим веществом которого является таурин. Дефицит таурина в печени приводит к нарушению желчевыделения и образования камней.
Желчные кислоты препятствуют развитию ожирения и тканевой резистентности к инсулину. Повышение растворимости гидрофильности желчных кислот достигается конъюгированием с аминокислотами глицином и таурином. Соединяясь с холевой кислотой, таурин образует парные желчные кислоты и непосредственно участвует во всасывании жиров и жирорастворимых витаминов, а также способствует выведению холестерина.
Дибикор может быть использован для коррекции и профилактики метаболических нарушений в терапии НАЖБП. Клиническая эффективность препарата Дибикор была оценена у больных с НАЖБП и СД типа 2, нарушением толерантности к глюкозе. Двойное слепое плацебо-контролируемое сравнительное исследование проводилось на базе ЦНИИГ.
Дибикор назначался по 0,5 г 2 раза в день за 20 минут до еды в течение 3 месяцев. Все больные продолжали получать подобранную терапию по поводу сахарного диабета – метформина гидрохлорид 1000мг\сут и эналаприла малеат 20 мг\ сут. Прием Дибикора статистически значимо улучшал показатели билирубина, АСТ, АЛТ, ХС, фибриногена, веса, ИМТ. АЛТ снижалась с 51,48±8,9 Е\л до 32,98±5,93 (Р=0,001), АСТ с 39,13±6,53 Е\л до 26,81±2,99 (Р=0,01), ГГТП с 68,86±17,56Е\л до 63,45±18,4. Снижались также метаболиты оксида азота с 220,7±14,27 до 123,9 ±8,13мкмоль\л и содержание эндотоксина с 2,2 ЕЭ\мл до 0,9 ЕЭ\мл.
Фармакотерапия больных НАЖБП с включением препарата Дибикор, который проявляет свойства антиоксиданта, способствует удалению свободных радикалов за счет повышения доступности глутатиона и гипотаурина, таурин ингибирует генерацию активных молекул перекисей и супероксидных анионов, тем самым снижается уровень малонового диальдегида и активность маркеров воспаления.
Применение Дибикора улучшает самочувствие больных, способствует нормализации АД, приводит к улучшению углеводного и жирового обмена, проявляет гепатопротективный эффект, что может быть использовано в лечении больных и профилактике НАЖБП.
Выводы
Выявлена взаимосвязь между маркерами воспаления (ФЛА2, NO, Эт, МДА), морфологической картиной печени и активностью печеночных ферментов.
Активность липопротеин-ассоциированной фосфо-липазы А2 при НАСГ у 40% больных была увеличена в 3,8 раза по сравнению с контрольной группой и сте-атозом, что сопровождалось повышением активности печеночных ферментов и тяжестью морфологических изменений. При НАЖБП развивается недостаточность антиок-сидантной системы в результате активации процессов ПОЛ. Содержание МДА в сыворотке крови было увеличено в 2 раза у больных НАЖБП при стеатогепатите в 30% случаев. Активность ФЛА2 и уровень МДА находятся в корреляционной зависимости (r=-578).
Повышение эндотоксина, оксида азота и активность ФЛА2 наблюдается при прогрессировании воспалительной инфильтрации в печени. Применение Дибикора в комплексной терапии НАЖБП снижает активность маркеров воспаления, оказывает положительный эффект на антиоксидантную систему клетки и удаление супероксидных радикалов.
Литература
1. Андреева Л. И., Кожемякин Л. А., Кишкун А. А. Модификация метода определения перекисей липидов в тесте с тиобарбитуровой кислотой // Лабор. дело. 1988. № 11. С. 41-43.
2. Буеверов А. О., Богомолов П. О., Маевская М. В. Патогенетическое лечение неалкогольного стеатогепатита: обоснование, эффективность, безопасность // Тер. архив. Т. 2007. № 8. С. 1-4.
3. Горожанская Э. Г. Свободнорадикальное окисление и механизмы антиоксидантной защиты в нормальной клетке и при опухолевых заболеваниях // Клин. лаб. диагн. 2010. № 6. С. 28-44.
4. Драпкина О. М. Атерогенная дислипидемия и печень // Приложение к журналу Consilium medicum. 2013. № 1. С. 52-56.
5. Жаворонок Т. В., Степовая Е. А., Рязанцева Н. В. и др. Нарушение окислительного метаболизма при острых воспалительных заболеваниях // Клин. лаб. диагн. 2006. № 12. С. 10-14.
6. Звенигородская Л. А., Нилова Т. В., Ткаченко Е. В., Варванина Г. Г. Клиническое значение определения содержания липопротеин-ассоциированной фосфолипазы А2 в диагностике НАЖБП // Гастроэнтерология. 2, 2013. Приложение Consilium medicum. C. 42-46.
7. Звенигородская Л. А., ЧеркашоваЕ. А., Нилова Т. В. Гиполипидемическая терапия у больных с НАЖБП // Эффективная фармакотерапия. Гастроэнтерология. № 2. 2012. С. 22-32.
8. Ивашкин В. Т., Драпкина О. М., Корнеева О. Н. Клинические варианты метаболического синдрома. – М.: ООО Издательство «Медицин. информац. агентство. – 2012. – 216 с.
9. Ивашкин В. Т., Маевская М. В. Липотоксичность и метаболические нарушения при ожирении // Рос. журн. гастро-энтер. гепатол. колопроктол. 2010. № 1. С. 4-13.
10. Ивашкин В. Т., Морозова М. А., Маевская М. В. Основные причины лихорадки у пациентов с нарушением функции печени // Рос. журн. гастроэнтерол. гепатол. колопроктол. 2010. № 1. С. 21-29.
11. Метельская В. А., Гуманова Н. Г. Оксид азота в регуляции биологических функций. Методы определения в крови человека // Лаб. медицина. 2005. № 7. С. 17-24.
12. Нозадзе Д. Н., Семенова А. Е., Каминная В. И. и др. Липопротеин ассоциированная фосфолипаза А2 – новая позиция в системе стратификации риска.// Атеросклероз и дислипидемии.2011№1 С.39-46
13. Титов В. Н. Альбумин. Транспорт насыщенных жирных кислот и метаболический стресс синдром // Клин. лаб. диагн. 1999. № 4. С. 3-11.
14. Титов В. Н., Дугин С. Ф. Синдром транслокации, липополисахариды бактерий, нарушения биологических реакций воспаления и артериального давления // Клин. лаб. диагн. 2010. № 4. С. 21-37.
15. Федосьина Е. А., Маевская М. В. Применение урсодезоксихолевой кислоты при неалкогольном и алкогольном стеатогепатите // Рос. журн. гастроэнтерол., гепатол. и колопроктол. 2010. № 3. С. 29-36.
16. Чернов Ю. Н., Васин М. В., Батищева Г. А. Патологические изменения клеточных мембран при ишемической болезни сердца и возможные пути фармакологической коррекции // Эксперим. и клин. фармак. 1992. Т. 57. № 4. С. 67-72.
17. Шульпекова Ю. О. Роль липидов в патогенезе НАЖБП // Рос. журн. гастроэнтерол., гепатол., колопроктол. 2012. № 1. С. 45-56. 18. Gorelick P. B. Lipoprotein-associated phospholipase A2 and risk of stroke. Am. J. Cardiol. 2008, 101 (12A) 34 F. – 40 F.
19. Li Z. Z., Berk M., McIntyre T. M. et al. Hepatic lipid partitioning and liver gamage in Nonalcoholic fatty liver disease role of steatoril-CoA desaturase // J. Biol. Chtm. 2009. 284 (9) 5637-44.
20. Lin K. T., Xue J. Y., Nomen M. et. al. Peroxynitrite-induced apoptosis in cells // J. Biol. Chem. 1995. 270, 16487-90.















