Фрагмин или гепарин что лучше
Применение аспирина или гепарина или и того и другого для улучшения исходов беременности у женщин с персистенцией антифосфолипидных антител и привычным невынашиванием беременности
Актуальность: Аспирин и гепарин широко используются в качестве профилактической стратегии для снижения высокого риска привычного невынашивания беременности у женщин с антифосфолипидными антителами (АФА). Этот обзор заменяет предыдущий, устаревший обзор, в котором оценивали все потенциальные методы лечения для привычного невынашивания беременности у женщин с АФА. В настоящем обзоре основное внимание уделяется более узкой области применения, поскольку в настоящее время клиническая практика ограничивается использованием аспирина или гепарина или обоих препаратов у женщин с АФА в попытке уменьшить осложнения беременности.
Цель исследования: Оценить влияние применения аспирина или гепарина, или того и другого для улучшения исходов беременности у женщин с персистенцией (наличием в двух отдельных пробах) АФА, либо с волчаночным антикоагулянтом (ВА), с антикардиолипином (АКЛ) или с антителами к aß2-гликопротеину-I (aß2GPI) или с их комбинацией, а также с привычным невынашиванием беременности (два или более случая, которые не обязательно должны быть последовательными).
Методы поиска: Был выполнен поиск в электронных базах данных Кокрановского реестра по беременности и родам, ClinicalTrials.gov, международной платформе реестра клинических исследований ВОЗ (ICTRP) (3 июня 2019 г.) и библиографических списках извлеченных исследований. Там, где это было необходимо, мы пытались связаться с авторами исследований.
Критерии включения: В обзор включали рандомизированные, кластерно-рандомизированные и квази-рандомизированные контролируемые исследования, оценивающие влияние применения аспирина, гепарина (либо низкомолекулярного гепарина (НМГ), либо нефракционированного гепарина (НФГ)) или комбинации аспирина и гепарина по сравнению с отсутствием лечения, с применением плацебо или других препаратов на исходы беременности у женщин с персистенцией АФА и привычным невынашиванием беременности. Были рассмотрены все схемы лечения.
Сбор и анализ данных: Два автора обзора независимо оценивали результаты исследований на предмет соответствия критериям включения и систематической ошибки. Два автора обзора независимо друг от друга извлекали данные и проверяли их на точность, а достоверность доказательств оценивали с использованием системы GRADE.
В целом качество доказательства было низким или очень низким из-за небольшого числа женщин в исследованиях и систематической ошибки. Доза и тип гепарина и аспирина различались в разных исследованиях. Одно исследование сравнивало применение только аспирина с использование плацебо; ни одно исследование не сравнивало применение только гепарина с использованием плацебо, и не было ни одного исследования, в котором не было группы, принимающей препараты сравнения во время беременности; пять исследований изучали эффективность использования гепарина (либо НФГ, либо НМГ) в сочетании с аспирином по сравнению с применением только аспирина; одно исследование сравнивало применение НМГ с использованием аспирина; в двух исследованиях сравнивали комбинацию НМГ плюс аспирин с комбинацией НФГ плюс аспирин; в двух исследованиях оценивали комбинацию различных доз гепарина в сочетании с аспирином. Во всех исследованиях использовали применение низких доз аспирина. Аспирин по сравнению с плацебо.
Мы не уверены, оказывает ли аспирин какое-либо влияние на частоту живорождения по сравнению с применением плацебо (отношение рисков (ОР) 0,94; 95% доверительный интервал (ДИ) 0,71-1,25; 1 исследование; 40 женщин; доказательства очень низкого качества). Мы не уверены, оказывает ли применение аспирина какое- либо влияние на риск развития преэклампсии, прерывания беременности, преждевременных родов с рождением живого плода, задержки внутриутробного роста или неблагоприятных событий у ребенка по сравнению с применением плацебо. Мы не уверены, оказывает ли применение аспирина какое-либо влияние на побочные явления (кровотечение) у матери по сравнению с использованием плацебо (ОР 1,29; 95% ДИ 0,60-2,77; 1 исследование; 40 женщин).
Качество доказательств этих результатов очень низкое из-за неточности, из-за малого числа включенных женщин и широкого 95%-ного ДИ, а также из-за систематической ошибки. Во включенных исследованиях не были зарегистрированы венозная тромбоэмболия и артериальная тромбоэмболия. Гепарин плюс аспирин по сравнению с применением только аспирина. Применение гепарин плюс аспирин может увеличить частоту живорождения (ОР 1,27; 95% ДИ 1,09- 1,49; 5 исследований; 1295 женщин; доказательства низкого качества). Мы не уверены, оказывает ли применение гепарин плюс аспирин какое-либо влияние на риск развития преэклампсии, преждевременных родов с рождением живого плода или задержки внутриутробного роста плода по сравнению с применением только аспирина из-за систематической ошибки и неточности вследствие небольшого количества включенных женщин и широкого 95%-ного ДИ. Мы не уверены, оказывает ли применение гепарин плюс аспирин какое-либо влияние на побочные явления (кровотечение) у матери по сравнению с применением только аспирина (ОР 1,65; 95% ДИ 0,19-14,03; 1 исследование; 31 женщина). Ни у одной женщины из группы «гепарин плюс аспирин» или группы «только аспирин» не было гепарин- индуцированной тромбоцитопении, аллергических реакций или венозной или артериальной тромбоэмболии. Точно так же ни у одного ребенка не было врожденных пороков развития. Применение гепарин плюс аспирин может уменьшить риск прерывания беременности (ОР 0,48; 95% ДИ 0,32-0,71; 5 исследований; 1295 женщин; доказательства низкого качества). При сравнении применения НМГ плюс аспирин и использования только аспирина общее ОР для частоты живорождения составило 1,20 (95% ДИ 1,04-1,38; 3 исследования; 1155 женщин). При сравнении применения НФГ плюс аспирин с использованием только аспирина ОР частоты живорождения составило 1,74 (95% ДИ 1,28-2,35; 2 исследования; 140 женщин).
Заключение авторов: Комбинация гепарина (НФГ или НМГ) и аспирина в течение беременности может увеличить частоту живорождения у женщин с персистенцией АФА по сравнению с применением только аспирина. Наблюдаемый положительный эффект гепарина был обусловлен одним большим исследованием, в котором применение НМГ плюс аспирин сравнивали с применением только аспирина. Во включенных исследованиях побочные явления не были зарегистрированы или были редкими. Для дальнейшей оценки потенциальных рисков и преимуществ этой стратегии лечения, особенно среди женщин с АФА и привычным невынашиванием беременности, необходимы дополнительные исследования, чтобы достичь консенсуса относительно идеальной профилактики привычного невынашивания беременности на основе профиля риска.
АНТИКОАГУЛЯНТЫ, ДЕЙСТВУЮЩИЕ НА ПРОЦЕСС ТРОМБООБРАЗОВАНИЯ
Ч. 1 Тромбоэмболия легочной артерии и тромбоз глубоких вен — самые распространенные причины смертности и инвалидности при сердечно–сосудистых заболеваниях.
Преферанская Нина Германовна
Доцент кафедры фармакологии образовательного департамента Института фармации и трансляционной медицины Первого МГМУ им. И.М. Сеченова, к.фарм.н.
Единственным доказательным по эффективности методом профилактики тромбозов и тромбоэмболических осложнений является применение антикоагулянтов, изменяющих вязкость крови, способствующих разжижению и повышению текучести крови. Стандартная схема лечения рекомендует начинать использовать антикоагулянты сразу после диагностирования таких заболеваний. Применение антикоагулянтов с момента появления симптомов позволяет предотвратить формирование сгустка крови, его увеличение и закупоривание сосудов. Большинство антикоагулянтов оказывают влияние не на сам кровяной сгусток, а на активность свертывающей системы крови.
Низкомолекулярные гепарины для парентерального введения (селективные ингибиторы фактора Ха)
Низкомолекулярные гепарины состоят из фрагментов гепарина с молекулярной массой от 2000 до 10 000 (в среднем 4000–5000 Да), получают путем фракционирования, гидролиза или деполимеризации обычного нефракционированного гепарина. В отечественной практике используют следующие препараты низкомолекулярных (фракционированных) гепаринов:
Эти препараты неоднородны по своему составу, т.к. содержат разные фракции гепарина и отличаются друг от друга антикоагулянтной активностью, физико-химическими и фармакокинетическими свойствами, но обладают антикоагулянтным и антитромботическим действием. Антикоагулянтный эффект продолжительный и зависит от действующего вещества (от 6 до 18 час.). При выборе антикоагулянта не учитывается возраст больных, тяжесть сопутствующих заболеваний, уровень тромбоза и степень нарушения внутрисердечной гемодинамики.
Низкомолекулярные гепарины блокируют процесс свертывания крови, угнетая в большей степени преимущественно активность фактора Ха, некоторые из них незначительно оказывают влияние на снижение образования протромбиназы (активатора протромбина) и активность фактора IIа. Протромбиназа (prothrombinase complex) — сложный комплекс, состоящий из активированных факторов свертывания Ха и Vа и др. факторов, который формируется на поверхности мембран тромбоцитов в присутствии ионов кальция. В процессе свертывания крови образуется как тканевая, так и кровяная протромбиназа. При применении антикоагулянтов количество образовавшейся протромбиназы очень мало, оно недостаточно для перевода протромбина в тромбин.
Прямые антикоагулянты катализируют образование комплекса с антитромбином III, тромбином и др. активированными факторами. Образуется тройной комплекс с антитромбином III, они необратимо изменяют его конфигурацию и сокращают период его полужизни до 3–6 часов. Связывание с антитромбином III усиливает угнетающее действие на активность фактора Ха, тем самым снижается переход протромбина в тромбин. В результате нейтрализации происходит ингибирование тромбина и формирование тромбов. В отличие от гепарина низкомолекулярные гепарины не связываются с фактором фон Виллебранда, легко инактивируются на поверхности тромбоцитов, что снижает риск геморрагических осложнений, реже развивается тромбоцитопения и остеопороз.
Низкомолекулярные гепарины, так же, как и гепарин, действуют на факторы свертывания через антитромбин III, но отличаются от гепарина следующими свойствами:
Низкомолекулярные гепарины способны блокировать каскад коагуляции на более ранних его этапах, обладают быстрым, выраженным, стабильным и более предсказуемым антикоагулянтным эффектом. Они имеют меньшее сродство к фактору 4 тромбоцитов и поэтому реже, чем стандартный гепарин, вызывают побочные эффекты. Фактор 4 тромбоцитов — антигепариновый, обладает выраженной антигепариновой активностью, устраняет эффект гепарина, его влияние на образование протромбиназы и на увеличение проницаемости сосудов. Антигепариновой активностью обладают также разрушенные и интактные тромбоциты, что связано со способностью тромбоцитов адсорбировать гепарин и его фрагменты и выделять фактор 4 тромбоцитов в плазму крови.
Применяют низкомолекулярные гепарины в основном для профилактики и лечения тромбоза глубоких вен (после хирургического вмешательства), для предупреждения тромбоэмболии легочной артерии. Низкомолекулярные гепарины показаны при нестабильной стенокардии, остром ишемическом инсульте и инфаркте миокарда, для профилактики и терапии тромбозов в акушерско–гинекологической практике, колоректальной и ортопедической хирургии. Их используют для профилактики свертывания крови в системе экстракорпорального кровообращения при длительном проведении гемодиализа или гемофильтрации.
Важно! При применении низкомолекулярных гепаринов могут возникать кровотечения. В первые дни лечения возможна умеренная тромбоцитопения. Низкомолекулярные гепарины в ряде случаев повышают активность печеночных ферментов, могут вызвать аллергические реакции и при длительном применении возникает опасность развития остеопороза. При передозировке протамин сульфат полностью не устраняет эффекты низкомолекулярных гепаринов (≤ 60%). Противопоказанием к их применению является повышенная чувствительность к тому или иному препарату, тяжелая почечная дисфункция, внутричерепное кровоизлияние, беременность, кормление грудью и др.
Формы выпуска низкомолекулярных гепаринов – специальные шприцы-дозаторы разового использования (в блистере по 2 шприца одноразового применения, упак. — 10 шт.).
Доза действующего вещества выражается в международных единицах (МЕ) с активностью подавления фактора Ха в плазме крови и выпускается в виде раствора для инъекций в мл.
Выпускается в растворе для п/к и в/в введения 2,5 м/0,5 мл. 0,5 мл помещают в специальный шприц с иглой вместимостью 1 мл, снабженный автоматической системой безопасности. После подкожной инокуляции Фондапаринукс полностью всасывается из места инъекции, выводится почками в течение 3 суток.
Важно! Применяют с осторожностью при повышенном риске развития кровотечений и гиперчувствительности к препарату. Препарат не рекомендуется смешивать с другими медикаментами.
ПРЯМЫЕ НИЗКОМОЛЕКУЛЯРНЫЕ АНТИКОАГУЛЯНТЫ ДЛЯ ПЕРОРАЛЬНОГО ПРИМЕНЕНИЯ
К пероральным антикоагулянтам, прямым ингибиторам фактора свертывания крови Ха (активированного фактора Стюарта–Прауэра) относят Апиксабан (Эликвис), Ривароксабан (Ксарелто).
Апиксабан (Эликвис, тб., покр. обол., 2,5 мг и 5 мг) является мощным прямым ингибитором фактора свертывания крови Xa. Он избирательно и обратимо блокирует активный центр фермента, угнетает активность протромбиназы. Для реализации его антитромботического действия не требуется наличия антитромбина III. В результате ингибирования фактора свертывания крови Xa изменяются значения показателей системы свертывания крови: удлиняется активированное тромбопластиновое время и протромбиновое время. Препарат опосредованно влияет на агрегацию тромбоцитов, оказывая антиагрегантный эффект. Апиксабан быстро всасывается из желудочно–кишечного тракта. Абсолютная биодоступность при приеме 10 мг достигает 50%, максимальная концентрация достигается в течение 3 час. после приема внутрь. Период полувыведения (Т½) составляет около 12 час. Прием пищи не оказывает влияния на фармакокинетические показатели. С белками плазмы крови связывается на 87%. Основным путем выведения является кишечник.
Важно! При временном перерыве в терапии Апиксабаном (преднамеренном или случайном) возрастает риск тромбоза. Пациентов следует проинструктировать о необходимости избегать таких перерывов. При временной остановке антикоагуляционного лечения по любым причинам оно должно быть возобновлено как можно скорее.
Не рекомендуется применять у пациентов с заболеванием печени и с повышенным риском кровотечений, во время беременности и в период грудного вскармливания.
Ривароксабан (Ксарелто, тб., покр. обол., 2,5 мг, 10 мг, 15 мг, 20 мг) — высокоселективный дозозависимый прямой ингибитор фактора Ха. Активация фактора X с образованием фактора Ха через внутренний и внешний пути свертывания играет центральную роль в коагуляционном каскаде. Высокая биодоступность (80–100%) наблюдается при приеме в дозе 10 мг, которая не зависит от приема пищи. При приеме натощак 20 мг препарата биодоступность составляла всего F=66%. Максимальная концентрация достигается через 2–4 час. после приема. Большая часть Ривароксабана (92–95%) связывается с белками плазмы крови.
Ривароксабан, 2,5 мг, применяют с целью профилактики смертности вследствие сердечно–сосудистых осложнений, инфаркта миокарда у пациентов после острого коронарного синдрома; 10 мг — в профилактике венозной тромбоэмболии у пациентов, которым проводят обширные ортопедические хирургические вмешательства на нижних конечностях, 15 и 20 мг – для лечения тромбоза глубоких вен и тромбоэмболии легочной артерии, а также с целью профилактики их рецидивов и для профилактики системной тромбоэмболии и инсульта у пациентов с фибрилляцией предсердий неклапанного происхождения.
Важно! Не рекомендуется применять препарат во время беременности, в период грудного вскармливания, детям и подросткам до 18 лет, при наличии болезней почек, при наличии злокачественных новообразований и гиперчувствительности у пациентов.
Основы антикоагулянтного лечения острого венозного тромбоэмболизма
Ежегодно в мире у 0,1% населения регистрируется венозный тромбоэмболизм (ВТЭ). С практической точки зрения, по современным представлениям, ВТЭ объединяет венозный тромбоз (ВТр) — тромбообразование в венозном русле кровообращения и венозную эмболию — пер
Ежегодно в мире у 0,1% населения регистрируется венозный тромбоэмболизм (ВТЭ). С практической точки зрения, по современным представлениям, ВТЭ объединяет венозный тромбоз (ВТр) — тромбообразование в венозном русле кровообращения и венозную эмболию — перенос части тромба в вены, дистальнее кровотока. Наиболее часто ВТЭ оказывается представлен тромбозом глубоких вен голени (ТГВ) и тромбоэмболией легочной артерии (ТЭЛА).
ТЭЛА — это одно из самых катастрофических осложнений, которое внезапно обрывает жизнь многих больных, унося каждый год только в США 150–200 тыс. жизней [1]. Существенное влияние на снижение риска фатального исхода ТЭЛА оказывают своевременно начатые диагностика и лечение. Неадекватная антикоагулянтная терапия может послужить причиной развития посттромбофлебитического синдрома, рецидивирующего тромбоэмболизма и тромбоэмболической легочной гипертензии. Без антикоагулянтной терапии в 11–26% случаев ВТЭ может осложниться ТЭЛА со смертельным исходом [2]. Поэтому после постановки диагноза ВТЭ целью лечения являются устранение симптомов болезни, предупреждение увеличения размеров тромба, эмболизации и ретромбозов.
Стандартная практика лечения больных с ТГВ и ТЭЛА принципиально не различается, так как наличие самой эмболии иногда служит единственным признаком того, что у больного имеется латентно протекающий эмбологенный тромбоз.
Стартовая терапия
Терапия ВТЭ начинается с 4–7-дневного введения гепаринов (нефракционированного или низкомолекулярного).
В таблице 1 представлены варианты выбора гепаринотерапии для стартового лечения.
Нефракционированный гепарин (НФГ). Гепарин — непрямой ингибитор тромбина, для осуществления антикоагулянтного действия которого необходим ко-фак-тор — антитромбин III. Комплекс гепарин-антитромбин III инактивирует несколько факторов свертывания: тромбин (II), Xa, XIIa, XIa, IXa. Среди них наибольшей чувствительностью к инактивации отличаются факторы Xa и IIa (тромбин). Кроме антикоагулянтного эффекта, НФГ, соединяясь с остеобластами, активирует остеокласты, ускоряя потерю костной ткани [3].
Определить концентрацию НФГ в крови невозможно, так как в свободном состоянии в циркуляции он отсутствует, поэтому дозу препарата необходимо подбирать, ориентируясь на оценку гипокоагуляции, вызываемой им. Наиболее приемлемым является тест определения активированного частичного тромбопластинового времени (АЧТВ). Рекомендованное терапевтическое удлинение АЧТВ основано на экспериментальных данных, показавших, что клинический эффект достигается при таком терапевтическом уровне НФГ, который удлиняет АЧТВ в 1,5–2,5 раза.
НФГ не обладает специфическим связыванием с определенными плазменными или клеточными белками, что предопределяет его различное гипокоагулянтное воздействие на пациентов. У 25% больных с ВТЭ, несмотря на получаемые ими дозы НФГ — более 35 000 ЕД в сутки, удлинение АЧТВ не достигает терапевтических значений. Данный феномен связан с так называемой резистентностью к НФГ [4]. Большинство из «резистентных» пациентов имеют достаточный уровень НФГ в крови, но повышенную концентрацию прокоагулянтов [5]. Не так часто встречаются случаи, когда у пациентов не удлиняется АЧТВ и не поддерживается достаточная концентрация НФГ, несмотря на вводимые высокие дозы препарата. Данный эффект является следствием нейтрализации гепарина белками плазмы крови, эндотелиальными клетками и повышенным клиренсом гепарина. Редко резистентность к НФГ вызвана низким уровнем антитромбина III. Основными причинами дефицита антитромбина являются гепатит, цирроз печени, нефротический синдром, беременность, прием оральных контрацептивов, синдром диссеминированного внутрисосудистого свертывания, острое воспаление и др. С практической точки зрения в данных клинических случаях определяющим фактором эффективности лечения НФГ является доза препарата, а не показатели АЧТВ [6].
При назначении НФГ с лечебной целью следует отдавать предпочтение внутривенному непрерывному способу его введения, который позволяет поддерживать оптимальные значения АЧТВ на протяжении суток. Для стартового лечения ВТЭ НФГ вводится путем внутривенной постоянной инфузии (1200–1300 ЕД/ч или 18 ЕД/кг/ч) после болюсной дозы 5000 ЕД или 80 ЕД/кг [5].
Для подбора дозы гепарина в зависимости от показателей АЧТВ используются алгоритмы, предложенные Американской ассоциацией сердца [7]. Алгоритм, представленный в таблице 2, следует задействовать в тех случаях, когда используются одинаковые реактивы АЧТВ и контрольное АЧТВ находится в одинаковых пределах. Первая доза одинакова для всех больных, дальнейшая скорость инфузии (32 000 ЕД/24 ч) относится только к первым 6 ч лечения, по прошествии этого времени необходимо корригировать дозу в соответствии с номограммой, исходя из значений АЧТВ.
В других случаях может быть применена номограмма, приведенная в таблице 3, в которой использованы не абсолютные величины АЧТВ, а его изменения по отношению к контрольному АЧТВ, определенному конкретной лабораторией.
Большие кровотечения при данном терапевтическом подходе составляют 2% и зависят от дозы препарата, возраста пациента, функционального состояния почек и печени, недавно перенесенных операций, травм и инвазивных процедур, злоупотребления алкоголем, сопутствующей терапии — тромболитических препаратов, антагонистов тромбоцитарных гликопротеинов IIb/IIIa, ацетилсалициловой кислоты [5].
Метаанализ результатов клинических исследований показал, что подкожное применение НФГ для лечения венозных тромбозов сопоставимо по эффективности и безопасности с внутривенным путем введения при условии подбора адекватных доз и надлежащего лабораторного контроля. Поскольку биодоступность НФГ при подкожном пути введения ниже (30%), чем при внутривенном, начальные дозы НФГ должны быть больше. Обычный режим для подкожного метода лечения НФГ включает начальный внутривенный болюс 5000 ЕД, далее подкожно дважды в сутки с последующим подкожным введением 17 500 ЕД и коррекцией дозы на основании АЧТВ [4, 8]. Для подбора дозы в зависимости от веса пациента и величины АЧТВ используют алгоритм, приведенный в таблице 4, при этом контроль АЧТВ проводится через 6 ч и далее по указанному протоколу.
Имеются результаты единичных исследований, в ходе которых изучалась эффективность подкожного введения НФГ для лечения ТЭЛА. Однако с достаточной уверенностью рекомендовать данный метод терапии не представляется возможным из-за небольшого количества достоверных клинических данных [10].
Гепарины низкого молекулярного веса (ГНМВ).
ГНМВ различаются по физико-химическим, биологическим, фармакологическим свойствам и нейтрализующей активности в отношении активного фактора Х (Ха) и тромбина (IIа), т. е. соотношения анти-Ха/анти-IIа-активности. Указанная гетерогенность имеет практическое значение: одинаковые дозы различных препаратов ГНМВ оказывают неодинаковое действие на фактор Ха и, как следствие, вызывают различный антикоагулянтный эффект. В связи с этим невозможно экстраполировать эффективность лечебного действия одного из ГНМВ на другие. Практически это разные препараты. Для контроля над эффективностью и безопасностью лечебного действия ГНМВ метод АЧТВ не применим, так как он не отражает антикоагулянтную активность используемых препаратов.
С этой целью применяется оценка инактивации активного фактора Х [5]. Доза низкомолекулярных гепаринов выражается в условных единицах (ЕД/кг массы тела), отражающих антифактор Ха-активность препаратов, определенную фирмой-производителем. В рутинной клинической практике лабораторный контроль за эффективностью ГНМВ не производится. Следует помнить, что подобранные по весу дозы ГНМВ адекватны для больных, чей вес не превышает 150 кг. Данной категории больных, а также беременным и пациентам с нарушенной функцией почек целесообразно определять анти-фактор Ха-активность вводимого препарата.
Анализ результатов исследований по оценке эффективности и безопасности подкожного применения фиксированных доз ГНМВ для лечения больных с ВТЭ в сравнении с НФГ, вводимым внутривенно в дозах, подобранных по АЧТВ, показал, что ГНМВ столь же эффективны в лечении и предупреждении рецидивов ТГВ/ТЭЛА как и НФГ, но реже вызывают геморрагические осложнения [11]. Это открыло путь к успешному изучению лечения неосложненных ТГВ и субмассивной ТЭЛА в амбулаторных условиях. Подтверждено превосходство ГНМВ над НФГ (доказана эффективность для надропарина кальция (фраксипарина) и эноксапарина натрия (клексана), что улучшает качество жизни больных и снижает стоимость лечения [12]. Однако у лиц с массивной ТЭЛА и высоким риском кровотечений (пожилой возраст, недавнее хирургическое вмешательство, кровотечения в анамнезе, заболевания почек и печени) данный вариант терапии не приемлем [5].
При использовании гепаринов более 5–7 сут возможно развитие гепарининдуцированной тромбоцитопении, которая обычно развивается между 3-м и 15-м днями после начала лечения, с частотой в среднем 2,4% при терапевтическом применении гепарина и 0,3% при назначении его с профилактической целью.
Необходимо подозревать гепарининдуцированную тромбоцитопению всякий раз, когда у пациента развиваются необычные изменения в клинико-лабораторных показателях в течение или вскоре после терапии гепарином. К таковым относятся: уменьшение количества тромбоцитов менее 100 000 в 1 мкл либо на 50% и более от исходного уровня на 5–10-е сутки от начала введения гепарина.
Оральные антикоагулянты-антивитамины К (ОАК–АВК). Для предотвращения дальнейшего увеличения размеров тромба и вторичных тромбоэмболических осложнений применяются ОАК–АВК. В зависимости от химической структуры молекулы антикоагулянта различают производные монокумарина и дикумарина, циклокумарины и индандионы.
Наиболее широко в мире применяются производные монокумарина — варфарин (кумадин) и аценокумарол (синтром, никумадин, синкулар), что обусловлено их оптимальной продолжительностью действия и хорошей переносимостью. Варфарин является препаратом выбора, так как время его нахождения в организме больного обеспечивает более стабильное воздействие на процесс свертывания крови, чем во время терапии аценокумаролом. Назначение весьма популярных в России фенилина и пелентана ограничивается токсичностью первого и неустойчивым антикоагулянтным эффектом второго (табл. 5).
При использовании ОАК для предупреждения рецидива ВТЭ его дозу рекомендуется подбирать таким образом, чтобы поддерживать значение Международного нормализованного отношения (МНО) на уровне 2,0–3,0 [13]. Терапия варфарином в период ее проведения редуцирует риск ретромбозов на 90–95% [14]. ОАК обычно назначается пациентам с ВТЭ одновременно с гепаринами непосредственно после эпизода тромбообразования. При достижении уровня МНО более 2,0 гепарин можно отменить.
Терапию ОАК рекомендуется начинать с поддерживающих доз: 2,5–5 мг для варфарина, 0,75–3 мг для маркумара, 1–4 мг для синкумара. Более низкие стартовые дозы показаны лицам старше 60 лет, уроженцам Азии, в особенности лицам китайского происхождения, пациентам с нарушением функции почек и печени, артериальной гипертензией, застойной сердечной недостаточностью, а также при сопутствующей терапии препаратами, усиливающими антикоагулянтный эффект ОАК.
Перед приемом препарата необходимо оценить общий анализ крови, протромбиновое время, АЧТВ, общий анализ мочи, определить функциональное состояние печени и почек. При рецидивирующем венозном тромбозе целесообразно провести скрининг на предмет тромбофилий. Среди наследственных факторов наиболее распространенными являются: генетическая мутация фактора V свертывания крови (фактор V Лейдена), мутация 20210А гена протромбина, а также мутация гена метилентетрагидрофолатредуктазы, приводящая к развитию гипергомоцистеинемии. Препарат принимается 1 раз в день в фиксированное время после еды. Контроль МНО проводится через 10–12 ч после приема препарата. На протяжении первой недели определение МНО рекомендуется производить ежедневно, затем 1 раз в неделю. Следует подчеркнуть, что расчет МНО производится в плазме, т. е. в венозной крови.
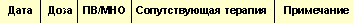 |
| Таблица 6. Дневник приема ОАК |
Перед началом терапии больному необходимо разъяснить особенности антикоагулянтной терапии ОАК. Пациент должен вести дневник по приведенному образцу (табл. 6), в котором отмечаются значения МНО, доза принимаемого препарата, сопутствующая терапия. Пациент должен сообщать врачу о любых заболеваниях, возникших во время лечения ОАК–АВК. Врачу рекомендуется вести специальную форму, в которой целесообразно записывать показания, по которым производится прием ОАК–АВК, планируемые значения МНО, предполагаемая продолжительность терапии, факторы риска кровотечения.
В таблице 7 приведен алгоритм подбора дозы в начале лечения варфарином [15]. Тактика лечения иными ОАК должна быть аналогичной под контролем МНО.
 |
| Таблица 7. Алгоритм стартового лечения варфарином |
После достижения необходимого уровня МНО алгоритм дальнейшего наблюдения должен быть следующим: первое определение МНО — через 5–10 дней, второе — через 2 нед, третье — через 3 нед, четвертое и все последующие — через 4 нед.
После диагностики тромбоза при определении длительности применения ОАК должны учитываться причины и выраженность тромбофилического состояния. Согласно существующим рекомендациям, терапия ОАК должна составлять не менее 3 мес у больных с симптоматическим тромбозом на фоне очевидных «обратимых» факторов, провоцирующих гиперкоагуляцию (травмы, операции и др.). Пациенткам с венозными тромбозами, возникшими на фоне гормональной заместительной терапии, лицам с «синдромом экономического класса» терапия продлевается до полугода. Не менее 1 года должны получать превентивное лечение ОАК пациенты со спонтанным венозным тромбозом [17, 18]. Больные с рецидивирующими венозными тромбозами, рецидивирующими тромбозами на фоне выявленных генетических тромбофилий нуждаются в постоянном приеме ОАК. Пациентам без эпизодов ВТЭ в прошлом, но с подтвержденным гетерозиготным дефицитом протеинов С и S, антитромбина III, с мутацией факторов V Лейден или протромбина G20210A некоторые специалисты [19] рекомендуют профилактическое назначение антикоагулянтов только при наличии выраженных приобретенных факторов риска тромбообразования, например при подготовке к оперативным вмешательствам. Такое лечение, по сообщениям этих авторов, предупреждает половину возможных тромбозов.
Применение ОАК при инвазивных процедурах. У пациентов группы низкого риска тромбоэмболий (венозный тромбоз более чем 3 мес назад, неосложненная системными тромбоэмболиями мерцательная аритмия) терапия ОАК прекращается за 3–4 дня до операции до достижения значений МНО менее 1,5. Если операция сопровождается риском тромбозов, кратковременно показаны профилактические дозы гепаринов, затем возобновление терапии ОАК.
У пациентов группы среднего риска тромбоэмболий ОАК отменяются за 4 дня до операции до достижения МНО 1,5. За 2 дня до операции назначаются либо низкие дозы НФГ (5000 ЕД подкожно) либо профилактические дозы ГНМВ. После операции — низкие дозы НФГ (или ГНМВ) и затем ОАК.
У пациентов группы высокого риска тромбоэмболий (венозный тромбоз менее 3 мес назад, рецидивы венозного тромбоза в анамнезе, протезы клапанов сердца в митральной позиции) ОАК отменяются за 4 дня до операции до достижения МНО 1,5. За 2 дня до операции назначаются терапевтические дозы гепаринов. Гепарины отменяются за 12–24 ч до операции.
Пациентам, у которых возникает необходимость удаления зуба, перед процедурой необходимо определить значения МНО. Если показатели остаются в пределах терапевтических значений, то процедуру можно проводить без коррекции терапии. Если значения МНО превышают 3,5, нужно пропустить один-два приема препарата. Следующие стоматологические процедуры не требуют коррекции дозы ОАК: пломбировка, установка коронки, мостов, чистка канала, снятие зубного камня [20].
Литература
Т. В. Козлова, доктор медицинских наук, доцент
Т. В. Таратута, кандидат медицинских наук
ММА им. И. М. Сеченова, Москва
