Сутулость при паркинсоне что делать
Сутулость при паркинсоне что делать
Н.В. Федорова, О.А. Орехова
Российская медицинская академия последипломного образования, Центр экстрапирамидных заболеваний (Москва)
Среди постуральных нарушений можно выделить такие крайние проявления, как камптоцефалия (синдром «свисающей головы»), синдром «пизанской башни» (тоническое латеральное сгибание туловища) и камптокормия (синдром «согнутой спины»). Эти симптомы значительно инвалидизируют пациентов, приводят к нарушению передвижения и самообслуживания. Две первые формы более характерны для мультисистемной атрофии, в то время как камптокормия (КК) встречается в основном при болезни Паркинсона (БП). Камптокормия (КК) клинический феномен, проявляющийся значительным непроизвольным наклоном туловища кпереди. КК нарастает при ходьбе, исчезает в положении лежа, приводит к вынужденной позе, нарастанию постуральной нестабильности и увеличивает риск падений при БП. Вопросы патогенеза до конца не изучены. Изначально КК считали крайним вариантом характерной для БП сгорбленной позы, возникающей вследствие ригидности мышц туловища. В последующем предположили, что КК может быть связана с миопатическими изменениями или является одной из форм сегментарной дистонии при БП [33]. Целесообразно заметить, что различные концепции патогенеза КК при БП по своему содержанию не противоречат друг другу, а скорее отражают его отдельные звенья. Так, фокальная миопатия паравертебральных мышц может формироваться вторично на фоне первичной туловищной дистонии и ригидности, отражая хроническое напряжение мышц, задействованных в компенсаторном выпрямлении туловища.
Кроме того, КК часто сопровождается болевым синдромом. Данные о распространённости и частоте КК при БП противоречивы: от 3,5% (Wenhui Fan et al., 2009) до 27,3% (Weintraub. et al., 2006).
КК при БП обычно появляется по мере прогрессирования заболевания. По данным некоторых авторов, пациенты с БП и КК характеризуются более старшим возрастом, большей длительностью заболевания, более выраженной степенью тяжести БП, большей продолжительностью терапии препаратами леводопы, большей суточной дозой леводопы, ранним присоединением аксиальных симптомов и более частой сопутствующей деменцией. Другие авторы, напротив, не находят корреляции между степенью сгибания туловища и возрастом, длительностью БП, стадиями заболевания и продолжительностью лечения и дозами леводопы. Для клинической оценки степени выраженности КК используют гониометрическое измерение степени тораколюмбальной флексии, рассчитываемой как угол между вертикальной плоскостью и плоскостью, проходящей через край акромиона. Как правило, КК считают переднюю флексию, превышающую угол наклона 45°.
Для дифференциальной диагностики КК из лабораторно-инструментальных тестов важны определение СОЭ, С-реактивного белка, электролитов (кальций и фосфор), креатинфосфокиназы (КФК), витамина Д, пирувата и лактата для исключения миозитов и митохондриальной патологии. Данные лабораторных обследований при КК обычно показывают нормальный или повышенный уровень КФК. По данным ЭМГ поясничных и грудных паравертебральных мышц отмечаются обильные фибрилляции, положительные острые волны и патологические разряды высокой частоты.
При КК целесообразно проведение нейровизуализационных методов исследования (КТ и МРТ грудного и поясничного отделов позвоночника, паравертебральных мышц, головного мозга), позволяющих исключить скелетно-мышечные заболевания или структурные изменения базальных ганглиев, однако данные этих методов при БП с КК не обладают специфичностью. Гистологическое исследование паравертебральных мышц при КК выявляет обширный фиброз и наличие жировой ткани с дегенеративными волокнами. Возможности терапии КК при БП достаточно ограничены. При всей сложности терапии КК в ее основе всегда лежит лечение основного заболевания.
Лечение должно включать консервативные мероприятия, отмену медикаментов, способных вызвать КК, хирургическую коррекцию или глубокую стимуляцию мозга.
В настоящее время определено, что эффективная терапия для КК при БП не найдена. В большинстве описанных в литературе наблюдений КК оказывается нечувствительной к стандартной противопаркинсонической терапии. Только в редких случаях возможно некоторое уменьшение выраженности КК, или же, напротив, ее усиление, чаще при приеме АДР. Поэтому при возникновении КК, связанной с изменениями дофаминергической
Болезнь Паркинсона и расстройства движений
терапии, целесообразна попытка коррекции медикаментозного лечения, прежде всего, исключение или замена одного препарата АДР на другой. Стероиды, по данным различных авторов, являются эффективными лишь в редких случаях БП с КК [26].
Данные об эффективности противосудорожных препаратов при КК противоречивы. Назначение препаратов других фармакологических групп (миорелаксантов, антиконвульсантов) чаще всего не эффективно. Однако, по мнению некоторых авторов, применение противосудорожного препарата клоназепама снижает выраженность КК при БП.
В комплексной терапии при КК обязательным должно быть включение физиотерапевтических и психотерапевтических методик. Иногда аномальное положение туловища улучшается при использовании заплечного рюкзака. Некоторые авторы предлагают использование для облегчения КК классических поясничных корсетов, кожаных ортезов. В настоящее время предлагается использование новых специальных ортезов, изготовленных по принципу торако-тазовой передней фиксации, которые дают неплохие результаты в лечении КК.
Локальные инъекции ботулинистического токсина (БТ) в клинически заинтересованные мышцы (подвздошную мышцу, прямую мышцу живота) при КК, ассоциированной с БП, дают неоднозначные результаты. При этом часто необходимо применение высоких доз БТ, обусловливающих развитие побочных эффектов. Различные авторы отмечают как положительную динамику, так и практически полное отсутствие эффекта на фоне регулярных инъекций БТ.
Хирургическое лечение КК складывается из стабилизирующих вертебральных вмешательств, а также хронической стимуляции глубоких структур мозга (DBS). Среди спектра хирургических операций на позвоночнике применяют заднюю тораколюмбальную фиксацию в сочетании с передним межпозвонковым артродезом на уровне нескольких позвоночных сегментов. При этом почти всегда лечение сопряжено с необходимостью длительной иммобилизации, стационарного наблюдения, повторными хирургическими вмешательствами и связанным с ними высоким риском осложнений.
В современной литературе постепенно накапливаются данные об использовании DBS в лечении ассоциированной с БП КК. Однако результаты применения DBS в этих случаях остаются противоречивыми. Кроме того, среди исследователей не сложилось единого мнения относительно выбора оптимальной структуры для DBS.
Таким образом, КК встречается при многих неврологических заболеваниях, самым частым из которых является БП. КК проявляется патологической позой с насильственным наклоном туловища вперед. Она возникает в вертикальном положении, усиливается при длительном стоянии или ходьбе и уменьшается в горизонтальном положении. В качестве причин развития КК при БП предполагают сегментарную аксиальную дистонию или локальную миопатию паравертебральных мышц, однако точные механизмы патогенеза изучены недостаточно. КК, ассоциированная с БП, значительно инвалидизирует пациентов, приводит к нарушению передвижения и самообслуживания.
Цель исследования: Определить клинические проявления синдрома КК при БП и влияние его на качество жизни больных.
Пациенты и методы исследования
В исследование было включено 90 больных БП, разделенных на две группы. Основную группу составили 70 больных БП с КК, средний возраст пациентов составил 68,9 ± 7,8 лет (от 53 до 86). Группу сравнения составили 20 пациентов БП без КК. Группа сравнения соответствовала основной по возрасту, полу, продолжительности заболевания и степени тяжести. Средняя степень тяжести по шкале Хен–Яру составила 3,4 ± 0,7 баллов, средняя продолжительность БП – 9,9 ± 5,6 лет. У 46 больных отмечалась смешанная форма заболевания (66%), у 19 – акинетико-ригидная форма (27%), дрожательно-ригидная форма наблюдалась у 5 больных (7%). Для оценки степени тяжести БП использовалась шкала Хен–Яра в модификации Линдвалла (Hoehn, Jahr, 1967; Lindvall et al., 1987); для оценки выраженности основных симптомов БП – унифицированная рейтинговая шкала БП (Unifed Parkinsons Disease Rating Scale – UPDRS, Fahn. et al., 1987); для оценки постуральной нестабильности – шкала Берга (Berg et al., 1992), шкала Тиннети (Tinetti et al., 1986), шкала нарушений ходьбы и равновесия (Gait and Balanse Scale, Jancovic, 2002); для оценки повседневной активности больных – шкала Schwab и England (1967); для оценки качества жизни больных БП – шкала PDQ-39 (Peto et al., 1995); для оценки степени выраженности КК и степени выраженности болевого синдрома – опросник КК (Margraf et al., 2010); для оценки влияния дофаминергических препаратов на выраженность КК использовался дневник Хаузера (Hauser et al., 2004).
Результаты и обсуждение
Средняя длительность КК составила 3,6 ± 3,0 лет. В общей группе преобладали пациенты с возрастом дебюта БП от 51 до 60 лет, в то время как КК возникала преимущественно у пациентов в возрасте от 61 до 70 лет. У 55 больных (78,6%) отмечался наклон вперед, у 15 больных (21,4%) – сочетание наклона вперед с наклоном в стороны. Тораколюмбальный угол составил 63,5±17,2 градусов, цервикокраниальный угол – 43,2±22,5 градусов. Болевой синдром наблюдался у 62 больных (88,6%). У 53 больных (75,7%) отмечалась четкая связь между появлением болевого синдрома в позвоночнике и началом развития КК. Болевой синдром был представлен в виде корешковой симптоматики у 20 пациентов (32,2%), в виде мышечно-тонического синдрома – у 37 пациентов (59,7%), у 5 пациентов (8,1%) наблюдалось сочетание корешкового и мышечно-тонического синдромов. Выраженность болевого синдрома оценивалась по опроснику КК и составила 54,9 ± 24,5%. Предшествующий вертеброгенный анамнез был выявлен у 46 больных (66%) в виде компрессионных переломов тел поясничных позвонков на фоне остеопороза, протрузий и грыж дисков на пояснично-крестцовом уровне, подтвержденных на основании КТ или МРТ пояснично-крестцового отдела позвоночника; имелись также проявления остеопороза, остеохондроза, спондилоартроза, подтвержденные данными рентгенографии грудного и пояснично-крестцового отделов. У 44 пациентов КК возникала уже в положении сидя (62,9%), у 21 – сразу при приеме вертикального положения (30%), у 2 – после прохождения 50 м (2,9%), у 3 (4,3%) – только после значительной нагрузки в вертикальном положении. У 54 пациентов (77,1%) КК наблюдалась в течение всего дня, у 4 (5,7%) – только в течение нескольких часов в дневное время, у 12 (17,1%) – возникала только вечером. КК вызывала ограничение повседневной активности на 51,6±25,6%. Факторами, усиливающими проявления КК, были статические нагрузки (2,9%), в 10% – стрессовые ситуации; физические нагрузки провоцировали развитие КК у 40 больных (57,1%); стрессовые и физические нагрузки вместе вызывали ухудшение КК у 6 больных (8,6%).
Для коррекции КК 10 пациентов (14,3%) использовали корсет; одному пациенту (1,4%) помогало ношение заплечного рюкзака; применение рюкзака и корсета были эффективны в одном случае (1,4%), в то время как 58 пациентов (82,9%) не использовали корригирующие приемы для уменьшения выраженности КК. Тридцать шесть пациентов (37,1%) с КК использовали при ходьбе трость, 4 (5,7%) были вынуждены использовать ходунки; сочетание трости и ходунков использовали 4 пациента (5,7%), 26 пациентов (37%) не нуждались в помощи при ходьбе.
Падения наблюдались у 29 пациентов (41,4%).
У большинства больных (65,7%) преобладал медленно прогрессирующий тип течения КК – постепенное начало в течение 1–6 месяцев и нарастание КК на протяжении нескольких лет.
Общая сумма баллов по шкале повседневной активности Schwab и England составила 68,3±19,5 баллов в основной группе и 72,0±15,8 баллов в группе сравнения; по шкале выраженности основных симптомов БП (UPDRS) – 54,7 ±17,9 баллов в основной группе и 53,2±18,9 баллов в группе сравнения; по шкале оценки качества жизни больных БП PDQ-39 – 106,0±21,3 баллов в основной группе и 100,1±25,3 баллов в группе сравнения).
У 58 больных (82,9%) четкой связи между появлением КК и началом приема дофаминергических препаратов не отмечалось, только у 18 больных (25,7%) выявлена четкая связь появления КК с началом дофаминергической терапии.
У 27 больных (38,6%) отмечалось ухудшение позы в off-периоде, у 8 пациентов (11,4%) в утренние часы после ночного перерыва в приеме препаратов отмечалось явное ухудшение позы, нивелирующееся в дневное время. Тридцати пяти пациентам с БП, у которых отмечалось нарастание позных расстройств в период выключения и в утренние часы (дистонии периода выключения и раннего утра), для удлинения эффекта однократной дозы леводопы и стабилизации концентрации препарата в крови был назначен комбинированный препарат препарат леводопа/карбидопа/энтакапон (Сталево) в средней суточной дозе 610 мг. Применение такого препарата, включающего ингибитор фермента катехол-О-метилтрансферазы (КОМТ) – энтакапон, является одним из конструктивных подходов к улучшению эффективности леводопатерапии. Процесс метилирования леводопы происходит на периферии (в желудочно-кишечном тракте и в кровеносном русле) и в головном мозге. При этом КОМТ отвечает за 10% катаболизма леводопы на периферии. Метилирование может быть заторможено путем назначения ингибитора КОМТ периферического действия энтакапона (рис. 1).
Рисунок 1. Оптимизация фармакокинетики леводопы.
Ингибиторы КОМТ увеличивают биодоступность леводопы, уменьшая уровень ее неактивных метаболитов. Энтакапон не проходит ГЭБ и препятствует метилированию леводопы в желудочно-кишечном тракте и кровеносном русле, благодаря этому сохраняется более высокий уровень леводопы, которая после прохождения ГЭБ служит материалом для синтеза дофамина в головном мозге. На фоне приема энтакапона период полужизни леводопы удлиняется на 25–75% (рис. 2).
Назначение Сталево больным БП с ухудшением позных расстройств в период окончания действия дозы леводопы позволило снизить выраженность тораколюмбального угла на 10% и болевого синдрома – на 35%, и тем самым улучшить качество периода «выключения». Терапия Сталево позволила значительно уменьшить выраженность моторных флуктуаций.
Рисунок 2. Изменение периода полужизни леводопы в плазме при добавлении энтакапона.
Заключение. Таким образом, согласно клиническим наблюдениям, большинство пациентов страдали от КК даже в положении сидя (62,9%), КК наблюдалась в течение всего дня (77,1%), ухудшение КК отмечалось после физической нагрузки или стресса (57,1% и 10% соответственно). В основном пациенты использовали для передвижения трость (37,1%); некоторые из-за тяжести КК даже вынуждены были использовать ходунки (5,7%). Более отдаленным последствием КК являлись нарастание постуральной нестабильности и увеличение частоты падений. У большинства пациентов БП с КК наблюдались боли в спине (88,6%) и имелся предшествующий вертеброгенный анамнез (66%). В значительном большинстве случаев КК была более инвалидизирующим фактором для пациентов, чем классические двигательные симптомы БП. У 25,7% пациентов выявлена четкая связь между появлением КК и началом дофаминергической терапии. У 51,4% больных отмечалась четкая зависимость степени выраженности КК от моторных флюктуаций: ухудшение в период выключения действия дофаминергических препаратов зафиксировано у 38,6% больных; у 11,4% пациентов отмечалось ухудшение позы в утренние часы. В данном исследовании выявлена эффективность нового трехкомпонентного препарата леводопа/карбидопа/энтакапон (Сталево) в лечении позных расстройств (дистонии мышц туловища) периода окончания дозы за счет стабилизации концентрации леводопы в крови и удлинения периода ее полужизни в плазме.
Болезнь Паркинсона: как с ней справляться
Рисунок 1. Применение антихолинергических препаратов, известных с прошлого века, для снятия тремора и ригидности ограничено из-за их побочных эффектов Каковы основные диагностические критерии болезни Паркинсона? Когда пациента необходимо
 |
| Рисунок 1. Применение антихолинергических препаратов, известных с прошлого века, для снятия тремора и ригидности ограничено из-за их побочных эффектов |
Каковы основные диагностические критерии болезни Паркинсона?
Когда пациента необходимо отправить к специалисту?
С каких препаратов начать лекарственную терапию?
Каким образом устранить побочное действие специфической терапии?
Причины паркинсонизма до сих пор неизвестны, а лечение остается симптоматическим, несмотря на то, что прошло уже четверть века с тех пор, как леводопа прочно внедрилась в жизнь больных паркинсонизмом.
Но не будем слишком пессимистичны — современные методы лечения продлевают жизнь таким больным и делают ее более или менее нормальной [1]. Один человек из тысячи страдает болезнью Паркинсона. Диагноз ставится на основании клинического синдрома, включающего гипокинезию, ригидность, тремор и нарушенные рефлексы позы. Уровень допамина снижается почти на 80% к моменту появления клинических признаков, поэтому неудивительно, что невозможно точно указать время появления первых симптомов.
Далеко не всегда просто отличить идиопатическую болезнь Паркинсона от других состояний, включая такое часто встречающееся, как эссенциальный тремор, и менее распространенные заболевания, которым присущи иные неврологические симптомы — супрануклеарный паралич, автономные нарушения или мозжечковые симптомы [2].
Патолого-анатомические исследования показывают, что каждый пятый диагноз в данной группе заболеваний ошибочен. Перед тем как поставить диагноз, важно убедиться в наличии по крайней мере двух из четырех основных клинических признаков, помня при этом, что у большинства пациентов симптоматика асимметрична. В сомнительных случаях помогает пробное лечение леводопой или допаминовыми агонистами [3].
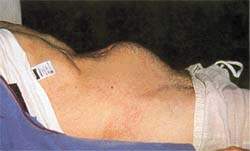 |
| Рисунок 2. Задержка мочи часто сопровождает болезнь Паркинсона |
Основной проблемой в контролировании болезни Паркинсона на сегодняшний день остается поздняя недостаточность допаминергической терапии, проявляющаяся в исчезновении или колебаниях реакции на препарат или в развитии дискинезий и прочих побочных эффектов у 75% пациентов после пяти лет лечения [4].
Расширение спектра препаратов и вновь возросший интерес к хирургическому лечению объясняется стремлением избежать или уменьшить проблемы длительного лечения.
Врач общей практики, подозревающий у пациента болезнь Паркинсона, должен решить, к кому его направить — к невропатологу, гериатру или другим специалистам. Особенно это важно в хронических прогрессирующих случаях у молодых людей, нуждающихся в длительном лечении.
Пациенту крайне необходимо рассказать о его болезни, прогнозе и сути применяемого лечения. Как и при астме, диабете и другом хроническом заболевании, врач и пациент должны действовать сообща, при активном участии последнего в принятии решений, касающихся лечения.
Как правило, с такими пациентами легко договориться, но по мере прогрессирования заболевания их приходится уговаривать принимать различные препараты несколько раз в день.
Контроль за заболеванием не сводится лишь к лекарственной терапии, напротив, психотерапия, трудотерапия, обучение навыкам речи и психологические методы существенно улучшают состояние пациентов [5]. Регулярная физиотерапия, назначаемая до допаминергических препаратов, замедляет прогрессирование заболевания [6], поэтому сразу после установления диагноза нужно советовать пациентам физические упражнения, соблюдение диеты, трудотерапию.
Весьма часто такие методы используются на более поздних стадиях заболевания, когда ничто другое уже не помогает, в то время как их нужно использовать для предупреждения развития болезни. Общество больных болезнью Паркинсона выпускает информационные сборники для персонала больниц и специальный обучающий материал для пациентов.
В ряде центров специально обученные сиделки помогают больным и тем, кто за ними ухаживает. Несмотря на отсутствие конкретных научных данных, многие пациенты признают эффект музыкотерапии, обучения, йоги и прочих дополнительных методов лечения.
Количество доступных препаратов и их новых форм в последние десять лет значительно увеличилось и обещает еще большее увеличение в ближайшем будущем. В табл. 1 приведены основные группы препаратов.
Таблица 1. Лекарственные препараты, применяемые для лечения паркинсонизма
антихолинергические препараты
Антихолинергические средства применялись еще в прошлом веке. Они до сих пор помогают справиться с тремором и, в меньшей степени, с ригидностью, практически не влияя на гипокинезию. Выбор среди них невелик. Все они имеют побочные эффекты: сухость во рту, нарушение аккомодации, запор и задержка мочи. У пожилых пациентов они склонны вызывать спутанность сознания и прочие психиатрические нарушения.
Следует отметить, что все антипаркинсонические средства способны вызывать подобные проблемы и любое нарушение ментальной функции требует пересмотра целесообразности применения и адекватности доз препарата. Леводопа, в настоящее время назначаемая вместе с ингибитором периферической декарбоксилазы (ИНД), остается пока самым эффективным лекарственным средством. В начале курса лечения могут возникать тошнота, рвота, поэтому пациенты предпочитают принимать их вместе с пищей или с противорвотными лекарствами — домперидоном и метоклопрамидом.
Необходимо учитывать, что большое потребление белка может мешать всасыванию леводопы.
Кроме психологических расстройств необходимо отметить и другие побочные эффекты — дискинезии или непроизвольные движения. Они бывают различными: движения языка и губ, гримасы, болезненные напряжения мышц, хореоатетоз, двигательное беспокойство. Снижение дозы препарата, как правило, уменьшает и дискинезию, однако пациенты часто предпочитают последнюю невозможности передвигаться вообще.
Другой элемент нарушений, возникающих при длительном лечении, — колебания реакции на препарат. Вначале это проявляется феноменом «выключения» — продолжительность действия леводопы-ИПД все время уменьшается. В тяжелых случаях человек внезапно переключается от движения, обычно с дискинезиями, к полной неподвижности.
 |
| Рисунок 3. Нарушение постуральных рефлексов — одна из составляющих клинического синдрома |
Для преодоления подобных проблем были разработаны формы с дозированным высвобождением препарата, позволяющие избежать колебаний концентраций лекарства в крови, и порошковые формы, обеспечивающие быстрое нарастание уровня лекарства в крови.
Агонисты допамина действуют на различные участки дофаминового рецептора. Соответственно разнится и их действие. Применяемые в одиночку, агонисты допамина менее эффективны, чем леводопа, но и реже приводят к колебаниям и дискинезиям [4]. Желудочно-кишечные побочные эффекты и воздействие на психику у них такие же. Апоморфин отличается от прочих упомянутых средств тем, что вводится путем инъекции.
По данным исследования, проведенного в Соединенных Штатах, селигин отсрочивает необходимость назначения леводопы, имеет нейропротекторные свойства и способен замедлять развитие болезни [7]. С тех пор, однако, было доказано, что селегилин сам по себе обладает умеренным допаминергическим эффектом, а также амфетаминоподобным и антидепрессантным воздействием; его защитные свойства в настоящее время находятся под сомнением [8].
Механизм действие селегилина — блокада моноаминоксидазы В, одного из основных ферментов допаминового метаболизма. Бытует мнение, что он потенциирует действие леводопы.
Ингибиторы катехол-о-метилтрансферазы (КОМТ) просто замедляют метаболизм допамина. По крайней мере два таких препарата уже готовятся к массовому производству [9, 10].
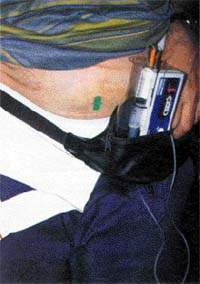 |
| Рисунок 4. Инъекции апоморфина применяют в трудно поддающихся лечению случаях |
Допаминергический эффект антивирусного препарата амантадина замечен еще много лет назад, но он менее эффективен, чем леводопы. Точный механизм его действия неизвестен, но все же его пытаются применять в случаях, резистентных к терапии леводопой; кроме того, его назначение совместно с леводопой позволяет уменьшить дозу последней.
Бесспорно, при назначении лекарственных препаратов следует учитывать возраст пациента, степень нарушений и индивидуальные особенности, однако невропатологи, как и другие специалисты, единого подхода к последовательности применения препаратов пока не разработали. Некоторые считают, что откладывать применение леводопы не имеет смысла, и начинают со стандартных схем ее использования.
Еще один подход заключается в использовании сначала пролонгированных форм, применении только дофаминового агониста или в сочетании с низкими дозами леводопы; или же назначают на какое-то время один селегилин, а затем присоединяют леводопу.
Какой бы схеме вы ни следовали, целесообразно начинать с низких доз, осторожно и постепенно подбирая необходимую дневную дозу. По возможности нужно избегать резких изменений в схеме приема или быстрого увеличения дозы.
При развитии феномена «выключения» нередко, хотя и на непродолжительное время, может оказаться полезным разделение дневной дозы препарата на несколько более мелких приемов. Можно попробовать присоединить к леводопе селегилин и/или агонист допамина, а также использовать вместо леводопы (или чаще дополнительно к ней) лекарственные формы пролонгированного действия. Биодоступность подобных форм меньше, чем у обычных препаратов, и их доза обычно несколько больше. У отдельных пациентов хороший результат дает прием препарата до, а не после еды или сокращение потребления белка.
В случаях с ярко выраженным феноменом включения-выключения используют те же приемы, в сочетании с индивидуальным подбором наиболее эффективной схемы лечения.
| Не рекомендуется устраивать длительные перерывы между приемами препаратов |
При отсутствии успеха от перорального приема препарата можно использовать такие новые методы, как подкожное введение апоморфина. Правда, для этого требуется обученный персонал, лучше всего — специальная сиделка для больных паркинсонизмом.
Другой подход — нейрохирургия. Проводят стереотоксическую паллидотомию или стимуляцию таламуса при феномене включения-выключения, а также при упорном треморе [11]. Имеющиеся на сегодняшний день данные обнадеживают. Они свидетельствуют об уменьшении дискинезии и удлинении периода включения. Однако, как и трансплантацию фетальных тканей, подобные хирургические методы пока следует считать экспериментальными, требующими дальнейшего изучения и оценки.
Кроме дискинезий и тремора, у многих пациентов при прогрессировании заболевания развиваются когнитивные и психические расстройства. При этом необходимо снижать дозу препарата.
Небольшие перерывы в приеме лекарств, отмена допаминергических препаратов на короткое время — такие «каникулы» (один-два дня каждую неделю) позволяют снизить психотоксичность [10]. Отмена препаратов на длительный срок не рекомендуется, поскольку может повлечь серьезные или даже необратимые нарушения способности двигаться.
Болезнь Паркинсона сопровождается нарушениями сна, депрессией, задержкой мочи, запорами, болями, расстройствами автономной нервной системы и сексуальными отклонениями. Все это поддается лекарственной коррекции. Просто надо дать возможность пациенту подробно описать все, что его беспокоит. Ограниченное время консультации вместе с тяжелыми проблемами общения, от которых страдают многие пациенты, могут быть преодолены посредством заранее подготовленного самим пациентом или сиделкой описания его состояния.
1. Clarke C. E. Mortality from Parkinson’s disease in England and Wales 1921-89. J. Neurol. Neurosurg Psychiatry 1993; 56:690-3.
2. Quinn N. Parkinsonism — recognition and differential diagnosis. BMJ 1995; 310:447-52.
3. Hughes A. J., Lees A. J., Stern G. M. Challenge test to predict the dopaminergic response in untreated Parkinson’s disease. Neurology 1991; 41:1723-5.
4. Marsden C. D. Parkinson’s disease. J. Neurol. Neurosurg Psychiat 1994; 57:672-81.
5. Patti F., Reggio A., Nicoletti F. et al. Effects of rehabilitation therapy on Parkinsonians’ disability and functional independence. J. Neurol. Rehab 1996; 10:223-231.
6. Doshay L. J. Method and value of physiotherapy in Parkinson’s disease. N. Eng. J. Med. 1962; 266:878-80.
7. Parkinson Study Group. Effects of tocopherol and deprenyl on the progression of disability in early Parkinson’s disease. N. Eng. J. Med. 1993; 328:176-83.
8. Jankovic J., Shoulson I., Weiner W. J. Early-stage Parkinson’s disease: to treat or not to treat. Neurology 1994; 44(suppl1):S4-S7.
9. Pouttinen H. M., Rinne U. K. A double-blind pharmocokinetic and clinical dose-response study of entacapone as an adjuvant to levadopa therapy in advanced Parkinson’s disease. Clin. Neuropharmac 1996; 19:283-96.
10. Stocchi F., Nordera G., Marsden C. D. Strategies for treating patients with advanced Parkinson’s disease with disastrous fluctuations and dyskinesias. Clin. Neuropharmac 1997; 20:95-115.
11. Obeso J. A., Guridi J., Delong M. Surgery for Parkinson’s disease. J. Neurol. Neurosurg. Psychiat 1997; 62:2-8.

