Талассемия что это такое
Публикации в СМИ
Талассемии
Талассемия xe «Талассемия» — гипохромная микроцитарная анемия с наследуемыми аномалиями генов глобинов. Талассемия распространена в средиземноморских странах, на Среднем Востоке и в Южной Азии.
Патогенез • Избыток непарных глобиновых цепей индуцирует образование нерастворимых тетрамеров, абсорбирующихся на мембранах эритроцитов и повреждающих их. Эритроидные клетки становятся чувствительными к разрушению фагоцитами костного мозга (отсюда дефектный эритропоэз) либо печени и селезёнки (отсюда гемолитическая анемия) • Отмечают относительную недостаточность фолиевой кислоты.
Клиническая картина • Гипохромная анемия • Вторичный гемохроматоз вследствие необоснованного применения препаратов железа и частых гемотрансфузий • Гемолитическая желтуха, холелитиаз и спленомегалия • Поражение суставов •• При большой талассемии — артрит голеностопных суставов, талалгия; возможно развитие вторичного подагрического артрита; костные деструктивные изменения в связи с нарушением кроветворения — «башенный» череп, седловидный нос •• При малой талассемии — короткие приступы синовиита крупных суставов без лихорадки, внесуставных симптомов и без развития деформаций • Дисплазии зубов.
Дифференциальная диагностика • ЖДА • Гемолитические анемии.
ЛЕЧЕНИЕ • Повторные переливания отмытых или размороженных эритроцитов • Дефероксамин 0,5–1 г/сут — при регулярном применении, образуя комплексное соединение с избытком железа, замедляет развитие гемосидероза • Фолиевая кислота 0,1–0,2 мг/сут • Антибиотикотерапия — при присоединении инфекции • Трансплантация костного мозга и спленэктомия — по показаниям.
Осложнения • Инфекции • Трофические язвы конечностей • Патологические переломы • Гемосидероз печени и сердца • Апластический или мегалобластный криз.
Синоним. Мишеневидноклеточная гемолитическая анемия
Код вставки на сайт
Талассемии
Талассемия xe «Талассемия» — гипохромная микроцитарная анемия с наследуемыми аномалиями генов глобинов. Талассемия распространена в средиземноморских странах, на Среднем Востоке и в Южной Азии.
Патогенез • Избыток непарных глобиновых цепей индуцирует образование нерастворимых тетрамеров, абсорбирующихся на мембранах эритроцитов и повреждающих их. Эритроидные клетки становятся чувствительными к разрушению фагоцитами костного мозга (отсюда дефектный эритропоэз) либо печени и селезёнки (отсюда гемолитическая анемия) • Отмечают относительную недостаточность фолиевой кислоты.
Клиническая картина • Гипохромная анемия • Вторичный гемохроматоз вследствие необоснованного применения препаратов железа и частых гемотрансфузий • Гемолитическая желтуха, холелитиаз и спленомегалия • Поражение суставов •• При большой талассемии — артрит голеностопных суставов, талалгия; возможно развитие вторичного подагрического артрита; костные деструктивные изменения в связи с нарушением кроветворения — «башенный» череп, седловидный нос •• При малой талассемии — короткие приступы синовиита крупных суставов без лихорадки, внесуставных симптомов и без развития деформаций • Дисплазии зубов.
Дифференциальная диагностика • ЖДА • Гемолитические анемии.
ЛЕЧЕНИЕ • Повторные переливания отмытых или размороженных эритроцитов • Дефероксамин 0,5–1 г/сут — при регулярном применении, образуя комплексное соединение с избытком железа, замедляет развитие гемосидероза • Фолиевая кислота 0,1–0,2 мг/сут • Антибиотикотерапия — при присоединении инфекции • Трансплантация костного мозга и спленэктомия — по показаниям.
Осложнения • Инфекции • Трофические язвы конечностей • Патологические переломы • Гемосидероз печени и сердца • Апластический или мегалобластный криз.
Синоним. Мишеневидноклеточная гемолитическая анемия
Талассемия что это такое
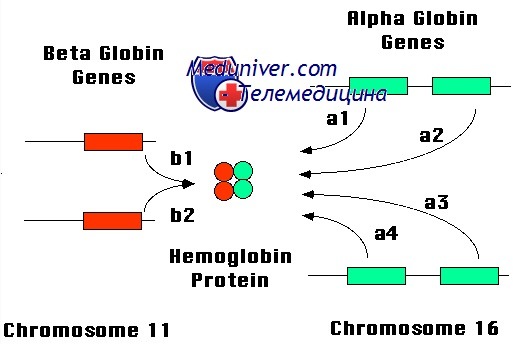
Этиология и встречаемость талассемии. Талассемии — аутосомно-рецессивные анемии, вызываемые недостаточным синтезом или а-, или бета-глобина. Относительная недостаточность а-глобина вызывает а-талассемию, а относительная недостаточность бета-глобина — бета-талассемию.
Талассемия чаще встречается среди лиц средиземноморского, африканского, ближневосточного, индийского, китайского и юго-восточно-азиатского происхождения. Как оказалось, талассемии распространены вследствие вызываемого ими селективного преимущества гетерозигот в отношении устойчивости к малярии; следовательно, распространение талассемии в разных этнических группах отражает прошлое и представляет влияние на популяцию малярии.
Распространение малой а-талассемии колеблется от менее чем 0,01% в областях, не подверженных малярии, например Великобритании, Исландии и Японии, до почти 49% среди аборигенов некоторых островов Тихого океана; болезнь HbH и водянка плода ограничены Средиземноморьем и Юго-Восточной Азией. Встречаемость малой р-талассемии колеблется от приблизительно 1-2% среди африканцев и афроамериканцев до 30% в некоторых деревнях Сардинии.
Патогенез талассемии
Талассемия возникает вследствие неадекватного синтеза гемоглобина и несбалансированного накопления субъединиц глобина. Неадекватный синтез гемоглобина вызывает гипохромию и микроцитоз. Несбалансированное накопление глобина вызывает неэффективный эритропоэз и гемолитическую анемию. Тяжесть талассемии пропорциональна тяжести дисбаланса между синтезом цепей а-глобина и р-глобина.
С талассемией связано более 200 различных мутаций, хотя большинство случаев талассемии вызвано только их небольшим числом. Делеция гена а-глобина дает 80-85% случаев а-талассемий, а приблизительно 15 мутаций вызывают более 90% случаев р-талассемий. Молекулярные исследования мутаций как а-глобина, так и р-глобина показывают, что различные мутации возникали независимо в разных популяциях, а затем достигали высокой частоты под влиянием отбора.
Фенотип и развитие талассемии
Мутации а-глобина разделяются на четыре клинических группы, которые отражают снижение синтеза а-глобина.
Фенотипы, наблюдаемые в популяции, отражают природу мутаций а-глобина в данной популяции. Хромосомы с делецией обоих генов а-глобина встречаются в Юго-Восточной Азии и Средиземноморском бассейне; следовательно, болезнь HbH и водянка плода обычно встречаются в этих популяциях, но не у африканцев, обычно имеющих хромосомы с делецией только одного а-глобинового гена в хромосоме.
Мутации бета-глобина также подразделяют на клинические группы, отражающие ухудшение синтеза бета-глобина. Признак бета-талассемии связан с мутацией в одном аллеле бета-глобина, а большая бетар-талассемия — с мутациями в обоих аллелях бета-глобина. В общих чертах, пациенты с малой бета-талассемией имеют легкую гипохромную микроцитарную анемию, легкую эритроидную гиперплазию костного мозга и иногда гепатоспленомегалию; обычно они бессимптомны.
Пациенты с большой бета-талассемией имеют тяжелую гемолитическую анемию, развивающуюся по мере уменьшения синтеза HbF после рождения. Анемия и неэффективный эритропоэз приводят к задержке роста, желтухе, гепатоспленомегалии (за счет экстрамедуллярного кроветворения) и увеличению костного мозга. Приблизительно 80% больных без лечения умирают к 5 годам.
Больные, получающие лечение только переливаниями крови, умирают в возрасте до 30 лет от инфекций или гемохроматоза, а лица, получающие как переливание крови, так и терапию хелатами для выведения железа, обычно живут более 30 лет. Перегрузка железом, вызванная регулярными переливаниями крови и повышением внутрикишечного всасывания, вызывает сердечные, печеночные и эндокринные осложнения.
Особенности фенотипических проявлений талассемии:
• Возраст начала: детство
• Гипохромная микроцитарная анемия
• Гепатоспленомегалия
• Экстрамедуллярное кроветворение
Лечение талассемии
Начальный скрининг малой а- или бета-талассемий обычно проводят с помощью определения эритроцитарного индекса. Для пациентов без железодефицитной анемии диагноз малой р-талассемии обычно подтверждается обнаружением повышенного уровня HbA2 (a2q2) и HbF (а2у2), содержащих другие р-цепи из группы бета-глобина, или ДНК-анализом мутации, или обоими методами вместе. В отличие от этого, малая а-талассемия не сопровождается накоплением HbA2 или HbF, и подтверждается ДНК-анализом мутации или демонстрацией нарушенного соотношения а- и р-цепей.
Лечение болезни HbH в основном поддерживающее. Терапия включает добавление фолатов, исключение лекарств, обладающих оксидантными свойствами и препаратов железа, быстрое лечение инфекций и переливание крови. Изредка необходима спленэктомия.
Лечение бета-талассемий включает переливания крови, выведение избыточного железа, быстрое лечение инфекций, часто спленэктомию. Пересадка костного мозга — единственное эффективное в настоящее время лечение. Осуществляемые в настоящее время клинические испытания лекAPCтвенных средств, увеличивающих экспрессию HbF, могут улучшить течение бета-талассемий (но не а-талассемий).
Риски наследования талассемии
Если каждый из родителей имеет малую бета-талассемию, пара имеет 25% риска родить ребенка с большой бета-талассемией и 50% риска родить ребенка с малой бета-талассемией. Если один родитель имеет малую бета-талассемию, а другой — утроение гена а-глобина, эта пара также имеет 25% риск родить ребенка с большой бета-талассемией.
Как для а- так и бета-талассемий возможна пренатальная диагностика за счет молекулярного анализа ДНК плода из ворсин хориона или амниоцитов. Молекулярная пренатальная диагностика талассемий наиболее эффективна, если мутации у родителей известны заранее.
Пример талассемии. Ж.З., здоровая 25-летняя женщина из Канады, проходила у своего акушера-гинеколога обычный осмотр во время беременности. Результаты развернутого анализа крови показали легкую микроцитарную анемию (гемоглобин 98 г/л; средний объем эритроцита 75 мкм3). Сама Ж.З. вьетнамского происхождения, а ее муж — грек. Она не знала о каких-либо болезнях крови в свой семье и семье мужа.
Тем не менее электрофорез гемоглобина выявил слегка повышенный уровень НbА2 (а2q2) и HbF (а2у), указывающий на то, что пациентка имеет малую форму р-талассемии; молекулярный анализ обнаружил нонсенс-мутацию в одном аллеле бета-глобина и отсутствие делеций в гене а-глобина. Результаты обследования мужа показали, что у него также имеется нонсенс-мутация одного аллеля бета-глобина без делеций в гене а-глобина. При обращении семьи в генетическую клинику врач-генетик объяснил супругам, что у ребенка есть 25% риска развития большой бета-талассемии.
После обсуждения возможности пренатальной диагностики супруги решили пролонгировать беременность без дополнительных исследований.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Талассемия
Талассемия – наследственные гемоглобинопатии, характеризующиеся угнетением синтеза цепочечных белковых молекул, образующих структуру гемоглобина. Это приводит к повреждению мембраны эритроцитов и разрушению красных клеток крови с развитием гемолитических кризов. Признаками талассемии служат характерные костные изменения, гепатоспленомегалия, анемический синдром. Диагноз талассемии подтверждается клиническими и лабораторными данными (исследованием гемограммы, гемоглобина, миелограммы, электрофоретическим методом). Возможна пренатальная диагностика талассемии. В лечении талассемии применяются гемотрансфузии, терапия десфералом, спленэктомия, трансплантация костного мозга.
МКБ-10
Общие сведения
Талассемия широко распространена среди населения Средиземноморского и Черноморского региона; название заболевания буквально переводится как «анемия морского побережья». Также случаи талассемии нередки в странах Африки, Ближнего Востока, Индии и Индонезии, Средней Азии и Закавказья. С синдромом талассемии каждый год в мире рождается 300 тыс. детей. В зависимости от формы патологии течение талассемии может быть тяжелым, фатальным или легким, бессимптомным. Так же, как серповидно-клеточная анемия, талассемия играет роль защитного фактора против малярии.
Причины талассемии
Талассемия является генетическим заболеванием с аутосомно-рецессивным наследованием. Непосредственной причиной патологии выступают различные мутационные нарушения в гене, кодирующем синтез той или иной цепи гемоглобина. Молекулярную основу дефекта могут составлять синтез аномальной матричной РНК, делеции структурных генов, мутации регуляторных генов либо их неэффективная транскрипция. Следствием подобных нарушений служит снижение или отсутствие синтеза одной из полипептидных гемоглобиновых цепей.
Так, при b-талассемии бета-цепи синтезируются в недостаточном количестве, что приводит к избытку альфа-цепей, и наоборот. Избыточно продуцируемые полипептидные цепи откладываются в клетках эритроидного ряда, вызывая их повреждение. Это сопровождается деструкцией эритрокариоцитов в костном мозге, гемолизом эритроцитов в периферической крови, гибелью ретикулоцитов в селезенке. Кроме этого, при b-талассемии в эритроцитах накапливается фетальный гемоглобин (НbF), не способный транспортировать кислород в ткани, что вызывает развитие тканевой гипоксии. Вследствие костномозговой гиперплазии развивается деформация костей скелета. Анемия, тканевая гипоксия и неэффективный эритропоэз в той или иной степени нарушают развитие и рост ребенка.
Для гомозиготной формы талассемии характерно наличие двух дефектных генов, унаследованных от обоих родителей. При гетерозиготном варианте талассемии пациент является носителем мутантного гена, унаследованного от одного из родителей.
Классификация
С учетом поражения той или иной полипептидной цепи гемоглобина различают:
Статистически чаще встречается β-талассемия, которая, в свою очередь, может протекать в 3-х клинические формах: малой, большой и промежуточной. По тяжести синдрома выделяют легкую форму талассемии (пациенты доживают до половой зрелости), средне-тяжелую (продолжительность жизни больных 8-10 лет) и тяжелую (гибель детей наступает в первые 2-3 года жизни).
Симптомы талассемии
Признаки большой (гомозиготной) b-талассемии проявляются уже в течение 1-2-го года жизни ребенка. Больные дети имеют характерное монголоидное лицо, седловидную переносицу, башенный (четырехугольный) череп, гипертрофию верхней челюсти, нарушение прикуса, гепато- и спленомегалию. Проявлениями анемизации служат бледный или землисто-желтушный цвет кожных покровов.
Малая (гетерозиготная) b-талассемия может протекать бессимптомно или с минимальными клиническими проявлениями (умеренным увеличением селезенки, незначительно выраженной гипохромной анемией, жалобами на повышенную утомляемость). Аналогичная симптоматика сопровождает течение гетерозиготной формы a-талассемии.
При гомозиготной форме a-талассемии альфа-цепи полностью отсутствуют; фетальный гемоглобин у плода не синтезируется. Данная форма талассемии несовместима с жизнью, что приводит к внутриутробной гибели плода вследствие развивающегося синдрома водянки или самопроизвольному прерыванию беременности. Течение гемоглобинопатии Н характеризуется развитием гемолитической анемии, спленомегалии, тяжелых костных изменений.
Диагностика
Талассемию следует заподозрить у лиц с семейным анамнезом, характерными клиническими признаками и лабораторными показателями. Больные талассемией нуждаются в консультации гематолога и медицинского генетика.
Типичными гематологическими изменениями служат снижение уровня гемоглобина и цветового показателя, гипохромия, наличие мишеневидных эритроцитов, повышение уровня железа сыворотки крови и непрямого билирубина. Электрофорез Hb на ацетат-целлюлозной пленке используется для определения различных гемоглобиновых фракций. При изучении пунктата костного мозга обращает внимание гиперплазия красного кроветворного ростка с высоким числом эритробластов и нормобластов. Молекулярно-генетические исследования позволяют выявить мутацию в локусе a- или β-глобина, нарушающую синтез полипептидной цепи.
На краниограммах при большой b-талассемии выявляется игольчатый периостоз (феномен «волосатого черепа»). Характерна поперечная исчерченность трубчатых и плоских костей, наличие мелких очагов остеопороза. С помощью УЗИ брюшной полости обнаруживается гепатоспленомегалия, камни желчного пузыря.
При подозрении на талассемию требуется исключить железодефицитную анемию, наследственный микросфероцитоз, серповидно-клеточную анемию, аутоиммунную гемолитическую анемию. В семьях, имеющих больных талассемией, рекомендуется проведение генетического консультирования супругов и инвазивной дородовой диагностики (биопсии хориона, кордоцентеза, амниоцентеза) для выявления гемоглобинопатии на ранних сроках беременности. Подтверждение гомозиготных форм талассемии у плода служит показанием для искусственного прерывания беременности.
Лечение талассемии
Лечебная тактика при различных формах талассемии неодинакова. Так, пациенты с малой b-талассемией в лечении не нуждаются. С другой стороны, больным с гомозиготной b-талассемией с первых месяцев жизни требуется проведение гемотрансфузионной терапии (переливание размороженных или отмытых эритроцитов), введение хелатирующих препаратов, связывающих железо (дефероксамина), глюкокортикоидов при возникновении гемолитических кризов. При всех формах талассемии показан прием препаратов фолиевой кислоты и витаминов группы В.
При гиперспленизме (особенно на фоне гемоглобиноза Н) требуется удаление селезенки (спленэктомия). Из-за склонности к присоединению инфекционных осложнений больным рекомендуется обязательная вакцинация против пневмококковой инфекции. Многообещающим методом лечения талассемии служит трансплантация костного мозга от гистосовместимого донора.
Прогноз
Прогноз больших форм талассемии неблагоприятный; больные погибают в младенческом или молодом возрасте. При гетерозиготной бессимптомной форме талассемии продолжительность и качество жизни в большинстве случаев не страдают. Первичная профилактика талассемии включает предупреждение браков между гетерозиготными носителями генов заболевания, а при высоком генетическом риске рождения больного потомства – отказ от деторождения.
Талассемия
Название «талассемия» происходит от греческого слова «море», «thalassa», и переводится как «морская анемия», так как болезнь впервые была обнаружена у лиц, живущих у берегов Средиземного моря.
Глобин образует гемоглобин. Гемоглобин жизненно важен в организме, так как он входит в состав эритроцитов (красных кровяных клеток), которые переносят кислород от легких ко всем тканям и органам. Талассемия проявляется гемолитической анемией различной степени выраженности. Из-за разрушения неправильного гемоглобина эритроциты быстро разрушаются. Организм пытается скомпенсировать дефицит гемоглобина в организме и усиливает образование красных клеток крови в костном мозге.
Альфа-талассемия – результат недостаточного образования альфа-глобиновых цепей. Бета-талассемия – результат недостаточного синтеза бета-глобиновых цепей.
Клинические проявления талассемии
Легкие, клинически незначимые формы талассемии обычно представлены у гетерозигот, большинство которых являются здоровыми носителями этих заболеваний. В мазках крови этих людей специалисты могут увидеть изменение внешнего вида эритроцитов (красных кровяных клеток) в виде гипохромии (эритроциты более бледные, чем обычно), микроцитоза (уменьшение размера), мишеневид- ности, наличие клеток различной формы (пойкилоцитоз) и размера (анизоцитоз).
Клинически значимые формы талассемии включают следующие состояния:
Большая форма бета-талассемии (анемия Кули), которая проявляется тяжелой анемией (глубоким снижением гемоглобина) уже на первом-втором году жизни и необходимостью проведения переливаний донорских эритроцитов каждые 2-4 недели.
Промежуточная форма бета-талассемии, которая развивается в результате нали- чия генетических повреждений двух бета-глобиновых генов, наличие комбина- ции талассемического повреждения одного бета-глобинового гена с аномальным гемоглобином (например, HbE) или повреждение двух бета-глобиновых генов с нарушением работы альфа-глобиновых генов, или появление аномального HbE. Как правило, пациенты с промежуточной формой бета-талассемии не нуждаются в регулярных (частых) переливаниях донорских эритроцитов.
Гемоглобинопатия Н, которая имеет клинические проявления сходные с промежуточной формой бета-талассемии.
Считается, что промежуточная форма бета-талассемии (а также HbE-бета-талассемия, гемоглобинопатия HbE и гемоглобинопатия Н) в целом более легкая форма талассемии, чем большая форма бета-талассемии, т.к. они редко нуждаются в заместительных трансфузиях (переливаниях) донорских эритроцитов, но в не- которых случаях частота переливаний у них может учащаться: с возрастом, при развитии выраженного увеличения размеров селезенки (спленомегалии), при присоединении инфекций и во время беременности.
Какие проявления талассемии?
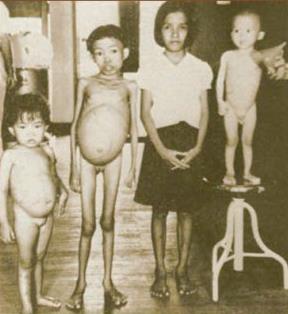
Фото 1. Дети, страдающие средиземноморской анемией тяжелой степени (последующие названия – анемия Кули, большая форма бета-талассемии) из публикации Cooley T.B. & Lee P. A series of cases of splenomegaly in children with anemia and peculiar bone changes. Trans Am Pediatr Soc, 1925; 37: 29-30
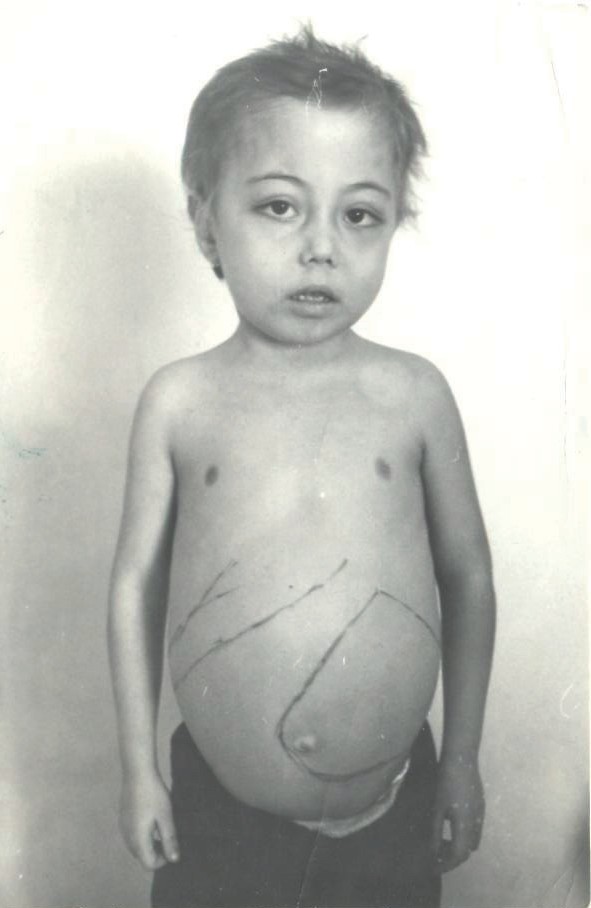
Фото 2. Внешний вид больного большой формой бета-талассемии 12-ти лет, не получав- шего лечение (60-е годы СССР).
Анемия – снижение гемоглобина – результат неэффективного образования эритроцитов в костном мозге и сокращения продолжительности жизни эритро- цитов, в тяжелых случаях анемия настолько выражена, что необходимо посто- янно проводить переливания донорских эритроцитов. Проявляется слабостью, одышкой, желтухой, интоксикацией и повышением температуры тела.
Перегрузка железом патологическое накопление железа в различных органах и тканях, результат переработки донорских эритроцитов организмом пациента в сочетании с резко повышенным усвоением железа из пищевых продуктов; последнее становится основной причиной накопления излишка железа у пациентов с промежуточной формой бета-талассемии. Накопленное железо повреждает печень, сердце и эндокринные железы и они не могут нормально работать.
Увеличение размеров селезенки (спленомегалия) различной выраженности. Увеличение размеров селезенки при сбалансированном ведении больных большой формой талассемии в настоящее время встречается редко и выражено незначительно. При неадекватном лечении селезенка быстро увеличивается в размерах за счет участия в кроветворении (начинает помогать костному мозгу образовывать эритроциты, но общий гемоглобин не повышается). Спленомегалия приводит к снижению эффективности проводимых переливаний донорских эритроцитов, а также к снижению численности других клеток периферической крови – тромбоцитов и лейкоцитов, такое состояние называется гиперспленизмом. При резком выраженном увеличении селезенки появляется высокий риск разрыва селезенки при малейшей травме живота, что представляет угрозу жизни. При промежуточной форме бета-талассемии спленомегалия – частое явление. Очень важно регулярно следить за размерами селезенки, особенно у пациентов с редкими трансфузиями донорских эритроцитов!
Экспансия кроветворения – расширение участков кроветворения в костном мозге. В норме кроветворение располагается в губчатых (плоские кости черепа, ребра, тела позвонков, кости таза) костях и трубчатых костях, с возрастом по мере старения организма – только в плоских костях. При возрастании потребностей организма в клетках крови, как например, при талассемии (промежуточной форме и при неадекватном лечении большой формы) высокая необходимость в эритроцитах, кроветворение занимает все возможные места естественной локализации кроветворения, приводя к утолщению и деформации костей. При экстремальном расширении кроветворения – клетки костного мозга выходят за пределы костей, образовывая опухолевидные образования – псевдоопухоли. За счет костных деформаций и утолщений, а также за счет псевдоопухоли, могут сдавливаться жизненно важные сосудистые и нервные сплетения, что может проявляться различными неврологическими симптомами (потеря чувствительности, чувство онемения, боли, нарушение функции мышц/органов, которые питаются из этого сплетения, и др.), симптомами сдавления (когда псевдоопухоль сильно сдавливает нормальные структуры, мешая их функции), остеопороз, патологические переломы, что также может сопровождаться болью и нарушением функции организма.
При проведении недостаточной трансфузионной терапии развиваются типичные талассемические деформации костей скелета увеличение размеров живота за счет спленомегалии, обусловленные расширением кроветворения, замедляются темпы физического роста и развития за счет глубокой анемии. Внешний вид боль- ных талассемией, не получающих лечение, представлен на фото 1 и 2.
Исследования для подтверждения талассемии
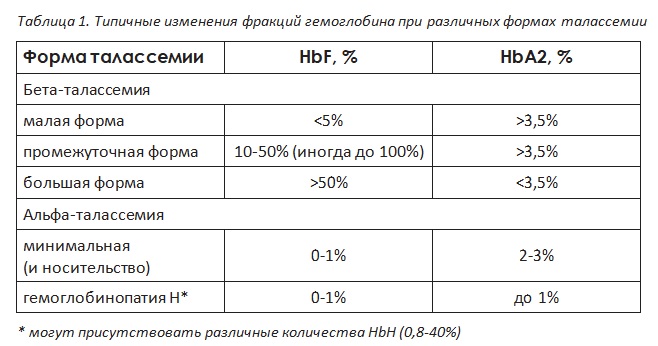
Исследование фракций гемоглобина методом капиллярного электрофореза или высокоэффективной жидкостной хроматографии. В случае талассемии будут изменены пропорции нормальных фракций гемоглобина или выявлен аномальный гемоглобин (см. таблицу 1).
ДНК-исследование глобиновых генов генов позволяет выявить как точковые мутации, так и делеции (потери фрагментов гена) различной протяженности. Знание характера мутации позволяет предположить возможную тяжесть заболевания. Часть поломок бета-глобинового гена позволяет сохраниться некоторому остаточному синтезу бета-глобиновых цепей, другая часть – делает синтез этих цепей полностью невозможным. Необходимо исследовать как бета-глобиновый ген, так и альфа-глобиновые гены в связи с крае высокой частотой встречаемости сочетанных поражений. Сочетание альфа- и бета-талассемии приводит к некоторому выравниванию баланса глобиновых цепей и смягчению клинических проявлений заболевания.
Ультразвуковое исследование (УЗИ) органов брюшной полости необходимо для оценки размеров печени и селезенки, состоятельности желчевыводящих путей.
Стандартная терапия талассемии
Больные малой формой бета-талассемии и здоровые носители талассемии не требуют лечения. Для них очень важно соблюдение здорового образа жизни : сбалансированное питание, двигательная активность, отсутствие вредных привычек (курение, алкоголь, употребление токсичных веществ), что позволит организму самостоятельно компенсировать генетический дефект.
Больные тяжелыми клиническими формами талассемии нуждаются не только в здоровом образе жизни, но и в специальном лечении.
Для всех пациентов с любой формой талассемии в любом возрасте принципиально важна двигательная активность – занятия физкультурой и спортом (без участия в соревнованиях), что позволит максимально поддержать минерализацию костей скелета, особенно при средне тяжелых и тяжелых клинических формах талассемии.
Трансфузионная терапия (переливания эритроцитной массы)
Пациенты с промежуточной формой бета-талассемии (и другими клинически схожими формами талассемии) в трансфузиях донорских эритроцитов нуждают- ся редко (например, при снижении гемоглобина менее 50 г/л, при сопутствующих инфекциях, при проведении хирургических операций, на время беременности, при выраженной задержке роста, легочной гипертензии, сердечной недостаточности, склонности к тромбозам, тяжелые костные деформации).
Пациенты с большой формой бета-талассемии для сохранения нормальных темпов роста и развития в детском возрасте, для сохранения качества и продолжительности жизни не отличающегося от здоровых людей – во взрослом возрасте, вынуждены регулярно каждые 3-4 недели в течение всей жизни получать трансфузии (переливания) донорских эритроцитов.
При назначении переливаний донорских эритроцитов врач подробно объяснит как будет проходить трансфузия, почему ее нужно проводить, проведет пробу на совместимость донорских эритроцитов с вашей кровью, объяснит какие могут быть реакции на переливание и что нужно вам делать в этих случаях. Необходимо внимательно выслушать доктора, если у вас возникнут какие-либо вопросы, не стесняйтесь, задайте их до начала трансфузии, и далее тщательно следуйте советам врача.
Это лечение, направленное на удаление избытка железа из организма пациента. Используются лекарственные препараты, разрешенные к медицинскому применению на территории Российской Федерации (деферазирокс); в случае непереносимости пациентом этих препаратов, решением Врачебной комиссии с соблюдением всех регламентируемых Российским законодательством норм может быть назначен препарат, незарегистрированный в России, но разрешенный в других странах мира для лечения перегрузки железом у больных талассемией (дефероксамин).
Исследования, необходимые для контроля лечения
Общий анализ крови с подсчетом числа тромбоцитов, лейкоцитарной формулы, ретикулоцитов и нормобластов (молодые ядросодержащие клетки красной крови, в норме отсутствуют в периферической крови), который позволит врачу оценить насколько адекватно организовано лечение клинически значимой формы талассемии.
Биохимический анализ крови с оценкой функции печени и почек, запасов железа в организме (ферритин сыворотки) позволяет оценить безопасность проводимой вам (вашему ребенку) терапии.
УЗИ органов брюшной полости и забрюшинного пространства – необходимо для оценки размеров печени, селезенки и почек, ранее выявление камней в желчном пузыре и псевдоопухолевых масс внекостномозгового кроветворения
Исследование функции сердца (ЭХО-КГ и ЭКГ, при необходимости суточное мониторирование ЭКГ) для всех пациентов с клинически значимыми формами талассемии с момента постановки диагноза и далее ежегодно.
Исследование гормонального профиля для всех трансфузионно зависимых пациентов старше 8 лет.
Исследование содержание железа в печени, миокарде и гипофизе до начала хелаторной терапии и для контроля освобождения органов от избытка железа.
Скрининг на инфекции, передающиеся с компонентами донорской крови (ВИЧ, гепатиты В и С) случае регулярных трансфузий – ежемесячно, при редких трансфузиях – ежегодно.
Оценка остроты зрения и слуха до начала хелаторной терапии и далее ежегодно.
Оценка минеральной плотности костей скелета ежегодно начиная с подросткового возраста.
Радикальная терапия талассемии
В настоящее время радикальной терапией клинически значимых форм талассе- мии считается трансплантация гемопоэтических стволовых клеток (ТГСК), источником которых может быть костный мозг, периферическая кровь и пуповинная кровь. Общая бессобытийная выживаемость больных талассемией после ТГСК достигает 98% при условии, что до этого больной получал адекватную терапию (трансфузии донорских эритроцитов при гемоглобине 95-100 г/л до Hb не менее 125 г/л в сочетании с хелаторной терапией (на фоне проводимой хелации ферритин сыворотки менее 1500 мкг/л), незначительное увеличение селезенки (не выступает ниже края реберной дуги), отсутствие признаков фиброза в печени.
В противном случае общая бессобытийная выживаемость – существенно ниже, а при тяжелой перегрузке железом печени и миокарда, наличии анемической кардиомиопатии, выраженной спленомегалии – не целесообразна в связи с крайне высоким риском гибели пациента.
В последние годы появилась информация по генной терапии, которая скоро сможет стать еще одной радикальной опцией лечения.
Что делать, если установлен диагноз «талассемия»?
Ваш лечащий врач должен отправить вас на консультацию к местному гематологу, который затем, должен дать направление в один из Федеральных центров, указанных ниже, для проведения диагностики (подтверждения талассемии) и назначения правильного лечения.
Для получения необходимого лечения также важно оформить инвалидность, поэтому в заключении лечебного учреждения, кроме информации о терапии, должны быть рекомендации о прохождении МСЭ по месту жительства.
В соответствии с Перечнем групп населения и категорий заболеваний, при амбулаторном лечении которых, лекарственные средства и изделия медицинского назначения отпускаются по рецептам врачей бесплатно, утвержденном постановлением Правительства РФ № 890 от 30.07.1994 «О государственной поддержке развития медицинской промышленности и улучшении обеспечения населения и учреждений здравоохранения лекарственными средствами и изделиями медицинского назначения», дети-инвалиды в возрасте до 18 лет обеспечиваются всеми лекарственными средствами по рецептам врачей бесплатно.
Кроме того, талассемия относится к гематологическим заболеваниям (наследственным гемопатиям), и препараты для лечения данных заболеваний и коррекции осложнений их лечения также должны предоставляться пациентам по рецептам врачей бесплатно.
ФЕДЕРАЛЬНЫЕ ЦЕНТРЫ, ОКАЗЫВАЮЩИЕ СПЕЦИАЛИЗИРОВАННУЮ ПОМОЩЬ ПАЦИЕНТАМ С ТАЛАССЕМИЕЙ
1. ФГБУ «Национальный медицинский исследовательский центр детской гема- тологии, онкологии и иммунологии имени Дмитрия Рогачева» Минздрава России (Москва)
Адрес: г. Москва, ул. Саморы Машела, д. 1
2. ФГБУ Национальный медицинский центр гематологиии МЗ РФ
Адрес: г. Москва, Новый Зыковский проезд, д. 4а
ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет имени академика И.П. Павлова министерства здравоохранения Российской Федерации», клиника НИИДОГиТ им. Р.М. Горбачевой.
Адрес: г. Санкт-Петербург, ул. Рентгена, д.12
Федеральное государственное бюджетное научное учреждение «Медико-генетический научный центр»
Адрес: г. Москва, ул. Москворечье, д. 1
Часто задаваемые вопросы
Наиболее вероятно у Вашего ребенка – талассемия, поэтому надо провести специальное обследование у гематолога (исследование фракций гемоглобина, ДНК-исследование глобиновых генов). После уточнения формы талассемии можно будет сказать как часто в дальнейшем надо переливать «кровь». Переливания необходимы для нормального роста и развития ребенка.
Задержка роста у ребенка с бета-талассемией, получающего переливания, может быть связана с двумя причинами:
— в результате переливаний донорских эритроцитов и/или длительно существующей глубокой анемии (Hb менее 90 г/л) происходит накопление излишка железа, которое нарушает рост костей; для устранения этой проблемы необходимо исследовать обмен железа и начать хелаторную терапию (выведение избытка железа из организма) или откоррегировать дозу препарата – хелатора железа.
При тяжелых формах бета-талассемии (промежуточная и большая формы) у больных нарушается обмен кальция, развивается остеопения и даже остеопороз, что сопровождается в том числе нарушением минерализации зубов. Необходимо провести исследования крови на содержание витамина Д и кальция в крови, после чего врач назначит необходимое лечение.
Вероятность рождения в семье второго больного ребенка составляет 25%, т.к. оба родителя являются носителями заболевания. В настоящее время в России можно провести пренатальную диагностику бета-талассемии и предотвратить рождение больных детей в семье. Для получения более подробной информации по пренатальной диагностике необходимо обратиться к генетику.
Пациентам с малой формой бета-талассемии при условии ведения здорового образа жизни ничего не угрожает, дети – развиваются как все здоровые дети, а взрослые имеют продолжительность и качество жизни как все остальные люди. При этом в общем анализе крови будут сохраняться типичные для заболевания изменения. Если нарушается питание (в рационе недостаточно свежих овощей и фруктов и/или мяса (рыбы)), то гемоглобин в крови будет ниже обычного; при малоподвижном образе жизни – нарушится формирование костей; при употреблении алкоголя (тоников) может развиться токсический гепатит в более раннем возрасте нежели у людей без бета-талассемии.
Больные большой формой бета-талассемии, получающие полноценное (адекватное) лечение – гемоглобин сохраняется в диапазоне 100-125 г/л, ферритин сыворотки всегда менее 1000 мкг/л, растут и развиваются как все здоровые дети и подростки, т.е. пубертат (половое развитие) наступит во время и репродуктивная функция страдать не будет. У таких пациенток может наступить беременность, которая благополучно завершиться
В случае не адекватного лечения половое развитие будет существенно отставать, а в результате избытка железа произойдет необратимое нарушение функции гипофиза, что сопровождается неизлечимым нарушением репродукции. Это значит, что самостоятельно беременность не наступит.
Девушки с большой формой бета-талассемии могут иметь клинически здоровых детей, т.к. они будут носителями бета-талассемии. Необходимо обследовать жениха на предмет носительства талассемии. Если он – носитель талассемии, то обязательное проведение пренатальной диагностики. За более подробной информацией вам нужно обратиться к генетику.
Трансплантация гемопоэтических стволовых клеток может быть проведена только при соблюдении следующих условий:
— нет увеличения печени и селезенки;
— нормально функционирует сердце;
— нет выраженной перегрузки организма железом;
— нет фиброза печени;
— возраст младше 14 лет;
— найден совместимый донор.
Если все условия соблюдены, то вероятность успешного завершения составляет более 95%.
Как правило, к 2-м годам больные с большой формой бета-талассемии и к примерно 7 годам с промежуточной формой бета-талассемии накапливают существенный избыток железа. Ферритин сыворотки при этом будет более 1000 мкг/л при большой форме и более 600 мкг/л при промежуточной форме. Желательно проводить дополнительное обследование – МРТ в режиме Т2* с расчетом накопления железа как в печени, так ив сердце, что позволит более точно подобрать правильную дозу препарата.
В настоящее время для выведения избытка железа в России есть два препарата – Эксиджад и Джадену. Оба препарата имеют одинаковую эффективность, отличаются лекарственной формой: Эксиджад – таблетки диспергируемые (т.е. перед употреблением их необходимо растворить как написано в инструкции), а Джадену – таблетки, покрытые кишечно-растворимой оболочкой (т.е. таблетку можно проглотить целиком или смешать с нежирной пищей после измельчения).
Не реже одного раза в год, частоту и объем обследования назначает ваш гематолог.
Врачи на основании клинических симптомов могут заподозрить болезнь. Затем проводятся лабораторные тесты и инструментальное исследование. СГХС обычно первоначально распознается по аномально высоким уровням ХС ЛПНП, определяемым по данным теста на холестерин. Кроме того, для подтверждения диагноза может быть выполнено генетическое тестирование. В анализе крови (развернутая липидограма), как правило, выявляют: повышение уровня общего холестерина, липопротеидов низкой плотности (ЛПНП), нормальный уровень липопротеидов высокой плотности (ЛПВП) и триглицеридов.
Семьям очень важно посетить врача генетика. Лечащие врачи не всегда имеют возможность поговорить с семьей и рассказать о всех рисках и возможностях, которые может предоставить современная генетика. У врача генетика можно узнать риск рождения больного ребенка в данной семье, пройти обследование родственникам, если это необходимо.
Где в России занимаются диагностикой и лечением можно прочитать в разделе КОНТАКТЫ