Таваник или леволет что лучше
ТОП-15 препаратов при цистите
Цистит – воспаление мочевого пузыря. Сопровождается частыми позывами и наличием дискомфорта в процессе мочеиспускания. Как правило, возникает на фоне бактериальной инфекции, но может также быть следствием повреждения или раздражения мочевого пузыря. Страдают как мужчины, так и женщины, причем последние, в силу анатомического строения, обычно сталкиваются с данным заболеванием значительно чаще.
Функции мочевого пузыря полностью определяют его структуру и положение в организме. Орган расположен в нижней части таза в забрюшинном пространстве за лобковой областью.
Классификация препаратов
Причины развития
Многие считают цистит исключительно женской болезнью, но данное мнение ошибочно. В силу анатомических особенностей, у мужчин данное заболевание развивается гораздо реже – что составляет примерно 5% случаев.
Среди предрасполагающих факторов следует выделить общее снижение иммунитета, нарушение процессов кровоснабжения из-за малоподвижного образа жизни. Также не стоит забывать о соблюдении личной гигиены и о том, что опорожнять мочевой пузырь нужно вовремя. Чаще всего заболевание возникает в весенний период.
Рейтинг препаратов от цистита
Как правило, цистит, вызванный бактериальной инфекцией, лечится с помощью антибиотиков, назначенных врачом. При легких формах заболевания специалист может назначить симптоматическое лечение, направленное на улучшение общего самочувствия. Своевременная медикаментозная терапия помогает исключить развитие осложнений.
Мы предлагаем ТОП эффективных препаратов от цистита, которые отличаются спектром действия. Рейтинг основан на эффективности и безопасности лекарственных средств. За основу взяты проведенные исследования и отзывы покупателей.
№1 – «Канефрон Н» (Бионорика СЕ, Германия)
Фитопрепарат, который назначается при заболеваниях мочевыводящих путей и почек. Таблетки, покрытые оболочкой, разработаны на основе корней любистока лекарственного, листьев розмарина и травы золототысячника обыкновенного.
Лучший препарат от цистита оказывает мочегонное, противовоспалительное, спазмолитическое и противомикробное действие. Используется в комплексной терапии лечения хронических инфекций мочевого пузыря.
Применение Таваника в урологии
Аляев Ю.Г., Султанова Е.А., Шпоть Е.В.
Таваник (левофлоксацин) обладает широким спектром антимикробного действия. Он входит в новую группу фторхинолонов, отличительной особенностью которых наряду с высокой активностью в отношении многих грамотрицательных бактерий является повышенная активность в отношении грамположительных микробов, атипичных микроорганизмов и анаэробов. Важным свойством препарата является его высокая активность в отношении внутриклеточных патогенов [5].
Таваник блокирует ДНК–гиразу (топоизомеразу II) и топоизомеразу IV, нарушает суперспирализацию и сшивку разрывов ДНК, ингибирует синтез ДНК, вызывает глубокие морфологические изменения в цитоплазме, клеточной стенке и мембранах.
Таваник, как и другие фторхинолоны, имеет выраженный постантибиотический эффект – продолжение антимикробного действия после удаления препарата из среды, длительность которого зависит от вида микроорганизма и величины ранее действовавшей концентрации [5].
Таваник характеризуется высокой степенью биодоступности и устойчивостью к трансформации в организме. Он хорошо проникает в разные органы и ткани; в тканях мочеполовой системы концентрация Таваника при использовании в терапевтических дозах соответствует или превышает концентрацию в сыворотке крови [3,4].
Выводится препарат преимущественно с мочой (70%), в которой создаются высокие концентрации, достаточные для подавления чувствительной к нему микрофлоры в течение долгого времени [5].
Длительная циркуляция препарата в организме в терапевтических концентрациях позволяет применять его 1 раз в сутки [5].
Как правило, Таваник хорошо переносится пациентами. Из побочных эффектов (3–10% случаев) следует отметить тошноту, рвоту, диарею, запор, головную боль, фототоксичность, реакции гиперчувствительности, удлинение интервала QT на ЭКГ, тендинит. Противопоказаниями к приему препарата служат гиперчувствительность, возраст до 18 лет, беременность, кормление грудью, эпилепсия, дефицит глюкозо–6–фосфатдегидрогеназы [5].
Таваник применяется в урологической практике для лечения таких заболеваний, как неосложненные и осложненные инфекции мочевых путей (ИМП), бактериальный простатит, неспецифический уретрит и некоторые виды специфических уретритов (вызванных инфекциями, передаваемыми половым путем), а также орхит и эпидидимит.
Неосложненные инфекции мочевых путей
Острая неосложненная ИМП – эпизод острой инфекции нижних (уретрит, цистит) или верхних (пиелонефрит) мочевых путей у пациентов при отсутствии у них каких–либо нарушений оттока мочи из почек и мочевого пузыря, структурных изменений в органах мочевой системы и серьезных фоновых заболеваний, которые могут утяжелить ее течение или привести к неэффективности проводимой терапии.
Рецидивирующая неосложненная ИМП – возникновение более двух эпизодов ИМП в течение 6 месяцев или трех эпизодов в течение 1 года.
Бессимптомная бактериурия – наличие двух последовательных (с промежутком в 1 неделю) положительных результатов бактериологического исследования мочи, при которых был выявлен один и тот же штамм возбудителя ИМП; клинические проявления заболевания при этом отсутствуют [2].
Неосложненные ИМП чаще встречаются у женщин. Каждая вторая женщина в мире, по меньшей мере, 1 раз в жизни переносит эпизод ИМП, из них у 25–40% женщин в течение ближайших 6–12 месяцев отмечается рецидив заболевания.
Лечение острых неосложненных ИМП можно проводить амбулаторно; госпитализация необходима лишь в серьезных случаях.
Richard G.A. et. al. изучили эффективность и безопасность применения Таваника в дозировке 250 мг один раз в сутки в сравнении с ципрофлоксацином в дозировке 500 мг дважды в сутки в течение 10 дней в лечении 385 пациентов, страдающих инфекцией мочевыводящих путей в рамках рандомизированного двойного слепого мультицентрового исследования. Всем больным перед началом лечения выполнен посев мочи, по данным которого у всех пациентов выявлен рост патогенной микрофлоры и микробное число составило 105 микробных тел в 1 мл мочи. Клиническое выздоровление отмечено у 92% пациентов, получавших Таваник, и у 88% пациентов, получавших ципрофлоксацин. Побочные эффекты отмечены у 4 и 3% пациентов соответственно. Авторы делают вывод, что эффективность и безопасность терапии Таваником сравнима с таковыми при использовании ципрофлоксацина, а в некоторых случаях даже превосходит их [7,8].
Схемы лечения больных острыми неосложненными инфекциями мочевых путей представлены ниже.
Острый неосложненный цистит: Таваник внутрь 250–500 мг 1 раз в сутки в течение 3–5 сут.
Острый неосложненный пиелонефрит легкого течения: Таваник внутрь 250–500 мг 1 раз в сутки в течение 7–14 суток.
При отсутствии улучшения или ухудшении состояния пациента показана госпитализация для дополнительного обследования, выявления осложняющих факторов, дренирования мочевых путей и возможного оперативного лечения. Госпитализация показана также при исходном среднетяжелом и тяжелом течении острого неосложненного пиелонефрита, наличии симптомов интоксикации, уросепсиса [2].
Острый неосложненный пиелонефрит среднетяжелого и тяжелого течения: Таваник внутривенно 500 мг 1 раз в сутки в течение 3–5 суток, затем внутрь 500 мг 1 раз в сутки (суммарный курс лечения – 2–3 недели).
Неосложненные ИМП (за исключением заболеваний, передаваемых половым путем) у молодых здоровых мужчин в возрасте от 15 до 50 лет встречаются очень редко. Как правило, ИМП у мужчин являются осложненными и обусловлены урологическими аномалиями, инфравезикальной обструкцией, инструментальными вмешательствами и дренированием мочевых путей [2].
Неспецифический уретрит у молодых мужчин: Таваник внутрь 250–500 мг 1 раз в сутки в течение 7 суток.
При обострении рецидивирующей неосложненной ИМП возможно применение Таваника по схемам, приведенным выше. Однако длительный прием препарата в качестве поддерживающей терапии часто является необоснованным из–за высокого риска развития дисбактериоза.
Осложненные инфекции мочевых путей
Осложненная ИМП – ИМП, которая развивается на фоне структурных или анатомических аномалий мочеполовых органов, а также сопутствующих заболеваний, снижающих защитные силы организма и увеличивающих риск восходящей инфекции или неэффективности лечения.
Для осложненной ИМП характерно наличие одного или более из следующих факторов:
• наличие постоянного мочепузырного катетера, катетера–стента, дренажей, интермиттирующая катетеризация мочевого пузыря;
• наличие остаточной мочи;
• обструктивная уропатия (инфравезикальная обструкция, нейрогенный мочевой пузырь, камни, опухоли мочевых путей и т.д.);
• пузырно–мочеточниковый рефлюкс и другие функциональные аномалии;
• реконструктивные операции на мочевых путях;
• химическое или радиационное поражение уротелия;
• пери– и послеоперационная ИМП;
• почечная недостаточность, сахарный диабет, трансплантация почки, иммунодефицитные состояния [2].
Тактика лечения зависит от тяжести заболевания и возможности устранения осложняющих факторов. В противном случае полное излечение ИМП невозможно. Лечение осложненной ИМП часто требует госпитализации больного. При этом антибактериальную терапию желательно проводить под контролем бактериологического исследования мочи.
Из антибактериальных средств наиболее эффективны фторхинолоны, которые экскретируются преимущественно почками, имеют широкий спектр антимикробного действия и достигают высокой концентрации как в моче, так и в тканях органов мочеполовой системы.
Y. Kawada, Y. Aso et. al. сравнили эффективность терапии Таваником в дозировке 250 мг дважды в сутки (135 пациентов) и офлоксацина в дозировке 200 мг дважды в сутки (126 пациентов) в терапии пациентов с осложненной мочевой инфекцией. Положительный клинический эффект получен у 83,7% пациентов в группе терапии Таваником и у 79,4% пациентов в группе терапии офлоксацином. С точки зрения статистики различий в эффективности лечения двух вышеописанных групп не было. Побочные эффекты отмечены у 4,9% пациентов в группе офлоксацина. В группе Таваника подобных эффектов отмечено не было, что, по мнению авторов, говорит о лучшей переносимости препарата [6].
Несмотря на то, что согласно различным исследованиям эффективность препарата близка к эффективности других хинолонов, очевидными преимуществами Таваника являются низкий уровень побочных эффектов, хорошая переносимость и возможность однократного суточного приема. При наличии камней почек или мочевого пузыря эрадикация возбудителя может способствовать торможению их роста. Если полное удаление камней невозможно, больному требуется длительная антимикробная терапия.
Присоединение инфекции на фоне обструкции верхних мочевых путей является крайне опасным и требует их экстренного дренирования. Проведение активной антимикробной терапии можно начинать только после устранения обструкции из–за высокого риска развития бактериотоксического шока.
Лечение бессимптомной бактериурии при наличии у больных постоянных катетеров или дренажей в мочевых путях, а также при интермиттирующей катетеризации мочевого пузыря не рекомендуется, т.к. приводит к селекции резистентных штаммов микроорганизмов и неэффективно для лечения микроорганизмов, входящих в состав пленки–biofilm. При наличии клинических проявлений таким больным показаны 7–10–дневные курсы антибиотиками широкого спектра действия.
Наличие сахарного диабета или иммунодефицита является показанием к лечению даже бессимптомной бактериурии.
В клиники урологии ММА имени И.М. Сеченова Таваник был назначен 114 пациентам с неосложненными инфекциями и 86 пациентам с осложненными инфекциями мочевых путей (острый обструктивный пиелонефрит) в возрасте от 19 до 63 лет (средний возраст 41 год). Среди пациентов с неосложненными инфекциями у 76 пациенток имел место острый цистит, у 38 – острый необструктивный пиелонефрит. Препарат назначался больным в дозировке 500 мг в сутки в течение 10 дней при неосложненных инфекциях и 14 дней – при осложненных. Результаты лечения оценивались на основании субъективной оценки эффективности и безопасности лечения пациентами и врачом, а также анализа объективных показателей: мониторинга анализов крови и мочи, ультразвукового мониторинга. Отсутствие клинического эффекта лечения определялось как сохранение или усиление клинических проявлений после 2 дней лечения.
В результате анализа данных, полученных в процессе исследования, положительный клинический и лабораторный эффект от лечения достигнут у 91% пациентов с неосложненными и у 82% – с осложненными инфекциями. При контрольном бактериологическом исследовании, выполненном через 2 недели после лечения, у пациентов с хорошим клиническим эффектом антибиотикотерапии, роста возбудителя не выявлено. Побочные эффекты применения Таваника отмечены у 3% пациентов. Наиболее часто встречались побочные реакции в виде тошноты и диареи. Следует отметить, что вышеописанное явления имели крайне низкую степень выраженности. Ни одному из пациентов не потребовалось проведение специального лечения в связи с вышеуказанными побочными реакциями, и ни один из них не покинул исследование.
Таким образом, фторхинолоны в настоящее время сохранили лидирующее место в лечении инфекций мочевых путей. По клинической эффективности эти препараты сравнимы с аминогликозидами и цефалоспоринами нового поколения, а в некоторых случаях (при смешанных инфекциях) превосходят их. Действие препаратов носит преимущественно патогенетический характер, и направлено на элиминацию из организма возбудителей воспаления.
При осложненных ИМП (за исключением случаев резистентности) Таваник применяют по следующей схеме: Таваник внутривенно 500 мг 1 раз в сутки в течение 7–14 суток.
При наличии показаний длительность лечения может быть увеличена до 3 недель.
ИМП при почечной недостаточности или трансплантации почки: Таваник внутрь 250–500 мг 1 раз в сутки в течение 10–14 суток.
В случае применения Таваника у больных с почечной недостаточностью следует учитывать, что при снижении клубочковой фильтрации Бактериальный простатит
Простатит – воспаление предстательной железы, которое может быть острым или хроническим (симптомы сохраняются >3 месяцев) [2].
Сегодня лечение хронического простатита не представляется без антибиотиков и противомикробных препаратов, среди которых наиболее предпочтительными являются фторхинолоны, отличающиеся широким спектром антимикробного действия, высокой бактерицидной активностью и хорошей фармакокинетикой. Фторхинолоны в отличие от нефторированных хинолонов имеют большой объем распределения, создают высокие концентрации в органах и тканях, проникают внутрь клеток.
Лечение простатита должно быть комплексным: помимо антимикробной терапии, необходимо адекватное дренирование выводных протоков ацинусов предстательной железы (при хроническом простатите проводится массаж простаты), а также применение различных физических методов (физиотерапии) с целью улучшения кровотока и обеспечения более активного противовоспалительного эффекта.
При выборе антибактериального средства следует учитывать спектр его антимикробной активности, а также способность проникать в ткань предстательной железы.
Фторхинолоны обладают хорошим внутритканевым проникновением, широким спектром антимикробной активности и являются препаратами выбора при лечении простатита. Возможность однократного применения делает предпочтительным назначение Таваника.
В клиники урологии ММА имени И.М.Сеченова эффективность Таваника оценена у 96 пациентов с хроническим бактериальным простатитом. Всем больным для подтверждения диагноза «хронический простатит» проводилась микроскопия секрета простаты. В редких случаях (около 10%), когда не удавалось получить сок предстательной железы, выполнялась спермограмма.
Большинству пациентов выполнялось исследование соскоба из уретры методом ПЦР. Отказ от выполнения соскоба уретры у ряда пациентов был связан с отрицательным результатом данного анализа до обращения в нашу клинику.
Материалом для бактериологического посева являлась сперма, собранная утром в день исследования в стерильную банку. Данный анализ проводился не всем пациентам. Критерием отбора для выполнения данного исследования являлся длительный анамнез лечения хронического простатита, что могло быть причиной множественной антибиотикорезистентности возбудителя.
Критерием исключения из исследования являлась полирезистентная флора, выявленная при бактериологическом исследовании.
Возбудители, выявленные при бактериологическом исследовании у пациентов основной и контрольной группы, обладали чувствительностью к большинству препаратов, в том числе фторхинолонам.
Оценка эффективности препарата проводилась через 1 месяц после начала лечения. Контрольное обследование включало микроскопическое исследование секрета простаты, бактериологическое исследование спермы и исследование соскоба из уретры методом ПЦР.
После лечения больных хроническим бактериальным простатитом жалобы полностью отсутствовали у 79 (82,3%) больных. У 3 пациентов отмечалось уменьшение клинической симптоматики. У 14 пациентов жалобы сохранялись, однако только у 5 среди 14 при контрольном микроскопическом исследовании секрета простаты сохранялись признаки воспаления.
Процент больных, у которых возбудители при контрольном обследовании не были выявлены, составил 89,6.
Клиническая эффективность применение Таваника у больных хроническим бактериальным простатитом составила 85,4%, эффективность микробиологическая – 89,6%.
Современные подходы к терапии хронического бактериального простатита
Хронический простатит (ХП) принадлежит к числу самых распространенных урологических заболеваний. По данным Н. А. Лопаткина (1998), в России на долю ХП приходится до 35% всех обращений к врачу по поводу
Хронический простатит (ХП) принадлежит к числу самых распространенных урологических заболеваний. По данным Н. А. Лопаткина (1998), в России на долю ХП приходится до 35% всех обращений к врачу по поводу урологических проблем среди мужчин в возрасте от 20 до 50 лет. Для получения данных о частоте встречаемости симптомов простатита с оценкой распространенности дизурии, дискомфорта в промежности и в области полового члена было проведено международное (Англия, Франция, Голландия, Корея) эпидемиологическое исследование Urepik. Анализ, проводившийся на основании шкалы симптомов Nickel и Sorensen (1996), дал возможность выявить признаки простатита у 4800 мужчин в возрасте от 40 до 79 лет. У 35% мужчин за последний год наблюдался как минимум один из симптомов простатита, и для 8% мужчин это представляло, по меньшей мере, неудобство [1].
На долю хронического бактериального простатита (ХБП) приходится 5–15% случаев заболевания [6]. Наиболее распространенными, по мнению большинства исследователей, этиологическими агентами ХБП являются такие грамотрицательные бактерии семейства Enterobacteriaceae, как Escherichia coli, которые обнаруживаются в 65–80% случаев инфекций. Различные виды Serratia, Klebsiella, Enterobacter, Acinetobacter выявляются у 10–15% больных. Большинство исследователей полагают, что на долю таких грамположительных бактерий, как Enterococcus faecalis, приходится от 5 до 10% случаев подтвержденных инфекций простаты [5].
В настоящее время обсуждается роль грамположительных бактерий — коагулазо-негативных стафилококков и стрептококков в развитии ХБП [5, 6, 7]. По нашим данным (Е. Б. Мазо и соавт., 2003, 2004) [1], основанным на результатах микробиологического исследования, которое проводилось в виде четырехстаканного теста Meares–Stamey у 70 больных с ХБП с 2002 г., именно коагулазо-негативные стафилококки играют ведущую роль (66%), если говорить об этиологии ХБП. Между тем на долю грамотрицательных патогенов приходится 19% случаев ХБП, а 15% составляют больные с Enterococcus faecalis. Аналогичными данными располагают М. Ф. Трапезникова и соавторы (2004), суммировавшие результаты идентификации 662 штаммов микроорганизмов у 264 больных ХБП, за которыми велось наблюдение в течение последних 13 лет. При этом выявлена ведущая роль грамположительных кокков в этиологии ХБП: за последние 3 года частота распространения коагулазо-негативных стафилококков составила 87,5% [3]. В то же время удельный вес грамотрицательных палочек — «общепризнанных» возбудителей ХБП — за предыдущие 7 лет неуклонно снижался (с 13,3 до 4,2%). С. Н. Калинина, В. П. Александров, О. Л. Тиктинский (2003) при обследовании 174 больных ХБП также выявили преобладание (82%) грамположительной флоры. Инфекция простаты может быть следствием бактериальной колонизации мочеиспускательного канала. Нормальная флора мочеиспускательного канала у мужчин состоит главным образом из дифтероидов и грамположительных кокков. Сексуальная активность может способствовать колонизации мочеиспускательного канала потенциальными уропатогенами. Blacklock (1974) и Stamey (1980) отметили, что секрет простаты у некоторых мужчин с ХБП содержал те же уропатогены, которые присутствовали в вагинальной флоре их сексуальных партнерш. Бактериальная колонизация может также вызвать персистенцию бактерий в простате. Отличительной чертой этого состояния является персистенция бактерий внутри простаты, несмотря на лечение антибиотиками, что связано с хроническим воспалением и склонностью к обострению инфекции мочевыводящего тракта тем же самым патогеном.
К предрасполагающим факторам развития ХБП относятся: уретропростатический рефлюкс; фимоз; анально-генитальные сношения без предохранения; инфекции мочевых путей; острый эпидидимит; постоянные уретральные катетеры и проведение трансуретральных операций у мужчин с инфицированной мочой без предшествующей антимикробной терапии [1]. У пациентов с ХП может быть выявлено нарушение секреторной функции простаты, характеризующееся изменением состава секрета, т. е. снижением уровней фруктозы, лимонной кислоты, кислой фосфатазы, катионов цинка, магния и кальция; цинксодержащего антибактериального фактора простаты. При этом увеличиваются такие показатели, как рН, отношения изоферментов лактатдегидрогеназы-5 к лактатдегидрогеназе-1, белков воспаления — церулоплазмина и компонента комплемента С3. Эти изменения в секреторной функции простаты также обусловливают неблагоприятное воздействие на антибактериальную природу секрета простаты. Уменьшение действия антибактериального фактора простаты способно снижать врожденную противобактериальную активность секрета, тогда как щелочной показатель рН может препятствовать диффузии в ткань и в секрет простаты основных антимикробных препаратов.
Симптомами ХП являются боли в тазовой области, расстройства мочеиспускания и эякуляции (см. табл. 1).
| Таблица 1 Симптомы хронического простатита | ||
| Локализация боли в тазовой области | Расстройство мочеиспускания | Расстройство эякуляции |
| В промежности В половом члене В яичках В паховой области Над лоном В прямой кишке В крестце | Учащенное мочеиспускание Неполное опорожнение мочевого пузыря Слабая или прерывистая струя мочи Боль или ее усиление во время мочеиспускания | Боли во время или после эякуляции Гемоспермия |
Ведущее место в лабораторной диагностике ХБП принадлежит микробиологическому исследованию — четырехстаканному локализационному тесту, предложенному в 1968 г. Meares и Stamey [8]. Он состоит в получении, после тщательного туалета наружных половых органов (во избежание контаминации поверхностными бактериями), первой (10 мл) и второй (средней) порций мочи для бактериологического исследования, массажа предстательной железы (ПЖ) со взятием секрета для микроскопии и посева, а также третьей порции мочи (после взятия секрета) для посева (рис. 1). Количественные посевы первой и второй порций мочи выявляют бактерии в уретре и мочевом пузыре, в то время как при посевах секрета простаты и порции мочи после взятия секрета (третьей порции мочи) выявляют флору простаты. ХБП характеризуется воспалительной реакцией в секрете (при микроскопии определяется более 10 лейкоцитов в поле зрения при большом увеличении). После инкубации посевов подсчитывают количество колониеобразующих единиц (КОЕ).
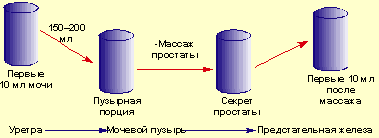 |
| Рисунок 1. Четырехстаканный локализационный тест Meares–Stamey |
Бактериологическое подтверждение ХБП мы проводим на основании, по крайней мере, одного из следующих критериев, предложенных K. G. Naber (2003):
Характерное для ХБП содержание патогенов в образцах примерно следующее:
первая порция мочи 3 КОЕ/мл;
вторая порция мочи 3 КОЕ/мл;
секрет простаты ≥ 10 4 КОЕ/мл;
третья порция мочи ≥ 10 3 КОЕ/мл.
Четкое соблюдение правил микробиологической диагностики и вышеуказанных критериев интерпретации результатов локализационного теста Meares — Stamey на большом количестве наблюдений позволят более точно определить частоту встречаемости истинных патогенов ХБП.
Антимикробная терапия. После идентификации этиологического агента и определения антибиотикорезистентности возникает необходимость назначения больному с ХБП антимикробной терапии. К факторам, оказывающим влияние на выбор антимикробного препарата для лечения ХБП, относятся: чувствительность идентифицированного микроорганизма к антибиотику, его способность в достаточной концентрации проникать через гематопростатический барьер и накапливаться в ткани и секрете простаты, сперме, а также способность препарата преодолевать экстрацеллюлярную полисахаридную оболочку, формируемую микроколониями бактерий, и хорошая переносимость при длительном пероральном приеме. Идеальный антибактериальный препарат для лечения ХБП должен быть жирорастворимым, слабощелочным, с коэффициентом диссоциации, способствующим максимальной концентрации препарата в простате [2]. Антимикробные средства из группы фторхинолонов на сегодняшний день отвечают вышеперечисленным требованиям и являются препаратами выбора для лечения ХБП. Особенностью антибактериального действия фторхинолонов является наличие двух мишеней действия в бактериальной клетке, каковыми являются ферменты (топоизомеразы II типа), ответственные за изменения пространственной конфигурации бактериальной ДНК: ДНК-гираза и топоизомераза IV. ДНК-гираза осуществляет суперспирализацию бактериальной ДНК, а топоизомераза IV — разделение дочерних хромосом в процессе репликации. Ключевым моментом в действии фторхинолонов является образование трехкомпонентного комплекса (бактериальная ДНК–фермент–фторхинолон). Указанный комплекс предотвращает репликацию бактериальной ДНК. Благодаря тому, что топоизомеразы обладают расщепляющей активностью, происходит разрушение молекулы ДНК (С. В. Сидоренко, 2002).
 |
| Рисунок 2. Классификация фторхинолонов (по K.G. Naber,1998) |
В настоящее время в практическое здравоохранение внедрены новые антимикробные препараты из группы фторхинолонов III и IV поколений, которые проявляют активность в отношении как грамотрицательных и грамположительных бактерий, так и атипичных внутриклеточных микроорганизмов, а также обладают способностью воздействовать на бактерии в биологических пленках (см. рис. 2). Антимикробная активность in vitro фторхинолонов III поколения — спарфлоксацина и левофлоксацина, а также фторхинолона IV поколения — моксифлоксацина наглядно представлена в таблице 2.
| Таблица 2 Антимикробная активность in vitro спарфлоксацина, левофлоксацина и моксифлоксацина (МПК90, мкг/мл) [4] | |||
| Микроорганизмы | Спарфлоксацин | Левофлоксацин | Моксифлоксацин |
| Acinetobacter spp. | 0,25 | 16 | 0,5 |
| Citrobacter freundii | 0,25 | 0,5 | 0,5 |
| Enterobacter cloacae | 0,5 | 0,5 | 0,5 |
| Escherichia coli | 0,12 | 0,12 | 0,5 |
| Klebsiella pneumoniae | 0,25 | 0,25 | 0,5 |
| Proteus mirabilis | 0,5 | 0,25 | 0,12 |
| Pseudomonas aeruginosa | 8 | 4 | 16 |
| Staphylococcus epidermidis | 1 | 1 | 2 |
| Staphylococcus saprophyticus | 0,25 | — | 0,5 |
| Enterococcus faecalis | 2 | 16 | 4 |
В 2004 г. мы сравнили чувствительность 25 различных штаммов коагулазо-негативных стафилококков — наиболее распространенных, по нашим данным (Е. Б. Мазо и соавт., 2003, 2004), этиологических агентов ХБП — к левофлоксацину, спарфлоксацину и моксифлоксацину. Бактериологическое исследование проводили классическим методом: выполняли посев мочи и секрета простаты на питательные среды с выделением чистой культуры и идентификацией выделенных штаммов при помощи полуавтоматического микробиологического анализатора Sceptor (Becton Dickinson, USA). Чувствительность выделенных микроорганизмов к левофлоксацину, спарфлоксацину и моксифлоксацину определяли дискодиффузионным методом на среде Мюллера–Хинтона. Результаты оценивали по значениям диаметров зон задержки роста. Всего было изучено 25 штаммов коагулазо-негативных стафилококков (21 — Staphylococcus haemolyticus, 3 — Staphylococcus epidermidis, 1 — Staphylococcus warnerii), выделенных в диагностическом титре из секрета простаты и мочи у больных ХБП при четырехстаканном тесте Meares–Stamey. Проведенный нами анализ чувствительности коагулазо-негативных стафилококков к фторхинолонам III и IV поколений показал наиболее высокую чувствительность этих бактерий к моксифлоксацину — у 24 (96%) штаммов. К левофлоксацину оказались чувствительны 21 (84%), а к спарфлоксацину 20 (80%) штаммов коагулазо-негативных стафилококков. Пять резистентных к спарфлоксацину штаммов были выделены нами у больных после длительной антимикробной терапии этим препаратом. Был выделен также штамм гемолитического стафилококка, резистентный ко всем фторхинолонам III и IV поколений у больного, ранее принимавшего в течение 6 нед моксифлоксацин. Проведенное исследование продемонстрировало высокую чувствительность коагулазо-негативных стафилококков, выделенных от больных ХБП, к фторхинолонам III и IV поколений. Чувствительность исследованных бактерий к моксифлоксацину оказалась наиболее высокой, в то время как к левофлоксацину и спарфлоксацину была практически одинаково ниже. Таким образом, длительная антимикробная терапия моксифлоксацином может привести к селекции устойчивых штаммов и развитию перекрестной резистентности к фторхинолонам III и IV поколений.
На сегодняшний день проведено ограниченное количество клинических исследований применения фторхинолонов в лечении ХБП. Результаты таких исследований, с периодом наблюдения не менее 6 мес, представлены в таблице 3.
Как видно из данных, приведенных в таблице 3, несмотря на существенные различия в количестве больных, принимавших участие в исследованиях, бактериальная эрадикация при различной длительности терапии фторхинолонами, наблюдалась более чем у 60% пациентов. Проведение подобных исследований в будущем, с соблюдением стандартов микробиологической диагностики, позволит выработать единый подход к рациональной антимикробной терапии ХБП.
Согласно актуальным на сегодняшний день рекомендациям Европейской ассоциации урологов по лечению инфекций мочевыводящих путей и инфекций репродуктивной системы у мужчин, принятым в 2001 г., длительность антимикробной терапии ХБП фторхинолонами или триметопримом должна составлять 2 нед (после установления предварительного диагноза). После повторного обследования больного антимикробную терапию рекомендуют продолжать суммарно в течение 4–6 нед только при положительном результате микробиологического исследования секрета простаты, взятого до начала лечения, или в случае, если у больного улучшилось состояние после приема антимикробных препаратов [2].
Антимикробные препараты, используемые для лечения ХБП, а также способы их применения приведены в таблице 4.
| Таблица 4 Способы применения антимикробных препаратов для лечения хронического бактериального простатита | ||
| Группа препаратов | Препараты | Способ применения |
| Фторхинолоны | Ципрофлоксацин (сифлокс, ципролет, цифран) | По 500 мг 2 раза в сутки |
| Офлоксацин (джеофлокс, заноцин, офлоксин 200) | По 400 мг 2 раза в сутки | |
| Ломефлоксацин (ксенаквин, ломфлокс, максаквин) | По 400 мг 1 раз в сутки | |
| Левофлоксацин (таваник) | По 500 мг 1 раз в сутки | |
| Спарфлоксацин (спарфло) | Первый прием 400 мг, затем по 200 мг 1 раз в сутки | |
| Моксифлоксацин (авелокс) | По 400 мг 1 раз в сутки | |
| Триметоприм/ сульфаметоксазол | Ко-тримоксазол (бикотрим, бисептол) | По 960 мг 2 раза в сутки |
Следует отметить, что больные с ХБП должны принимать антибиотик фторхинолонового ряда в течение длительного периода (от 4 до 6 нед) для предотвращения рецидива инфекции нижних мочевых путей. Продолжительная терапия антибиотиками в низких профилактических дозах или супрессивная антимикробная терапия могут применяться в случаях рецидивирующего или невосприимчивого к лечению простатита.
Литература
С. В. Попов
А. К. Чепуров, доктор медицинских наук, профессор
В. И. Карабак, кандидат медицинских наук
РГМУ, Москва


