Теломерный тест что это
Что такое теломеры и теломераза
Доктор Элизабет Блэкберн, открывшая теломеразу, получила мировую славу и Нобелевскую премию. Она сравнила теломеры с пластиковыми наконечниками на концах шнурков, которые не дают им распутаться.
Этот фермент способен компенсировать износ теломер. Однако у людей теломераза активна только на эмбриональном этапе развития. У взрослых же этот фермент ограничивают стволовые и половые клетки, а также некоторые клетки крови.
Теломеры защищают концы хромосом, где записано наше генетическое наследие. Этот код ДНК используется, в том числе, для передачи информации клеткам, чтобы они производили определенные белки ( гормоны, ферменты и т. д.), обеспечивающие их правильное функционирование.
По теории доктора Блэкберн, концевые участки ДНК могут удлиняться и, тем самым, тормозить старение организма.
Теломеры и старение
Исследователи обнаружили, что длина теломер связана с потенциальной продолжительностью жизни каждого человека и помогает определить возраст клетки. К 80 годам длина теломер с рождения сокращается вдвое.
Укорочение теломер и активность теломеразы связаны, например, с развитием рака и сердечно-сосудистых заболеваний, а также со снижением иммунитета.
Считается, что биологический возраст человека можно определить по длине его теломер. Несколько лабораторий в разных странах мира даже предлагают такую услугу за несколько сотен евро.
Кроме того, о состоянии теломер может рассказать образ жизни человека. По крайней мере, об этом говорят исследования 2011 и 2012 годов.
Теломеры укорачиваются из-за следующих факторов:
нездоровое питание (переизбыток сахара и омега-6 в рационе, употребление переработанных продуктов);
переедание и лишний вес;
загрязнение окружающей среды (химическое, электромагнитное, звуковое);
плохие эмоциональные и социальные отношения с другими людьми;
ТЕЛОМЕРНЫЙ ТЕСТ (АНАЛИЗ КРОВИ НА ТЕЛОМЕРЫ)
ПОНЯТИЕ БИОЛОГИЧЕСКОГО ВОЗРАСТА
Выраженность и стойкость эффекта омоложения, достигаемого за счет косметологических процедур, зависит от ряда факторов. Один из таких факторов – биологический возраст, который, как правило, не совпадает с хронологическим (паспортным) возрастом. У одних людей биологический возраст ниже хронологического, у других, наоборот, – выше. Чем хуже состояние клеток – «кирпичиков», из которых «построены» наши органы и системы, тем выше биологический возраст человека.
Современная медицинская наука располагает диагностическими инструментами, способными выявлять биологический возраст. Например, определить его можно по некоторым гормональным показателям. В настоящее время у врачей не вызывает сомнений четкая связь между снижением уровня половых гормонов (как у женщин, так и у мужчин) и развитием ассоциированных с возрастом заболеваний. Однако наиболее точным способом оценки биологического возраста является длина лейкоцитарных теломер.
ЧТОБЫ УЗНАТЬ, КАКАЯ У ВАС ДЛИНА ТЕЛОМЕР,
нужно сдать анализ крови из вены натощак.
ЧТО ТАКОЕ ТЕЛОМЕРЫ И ЧТО ОЗНАЧАЕТ ИХ УКОРОЧЕНИЕ
Теломеры – это концевые участки хромосом, защищающие ДНК в процессе репликативного деления. Теломеры укорачиваются с каждым делением клетки, пока не наступает момент неспособности клетки к делению. С возрастом длина теломер уменьшается! Клетки с критически короткими теломерами перестают функционировать в здоровом режиме и устранять повреждения, они начинают отравлять организм продуктами своей жизнедеятельности и даже «атаковать» молодые и здоровые клетки, пытаясь занять их место. У человека повышается риск генетических мутаций и онкологических заболеваний.
Всем, кто стремится как можно дольше сохранять молодой и привлекательный внешний вид, важно знать, что клетки с критически короткими теломерами выделяют вещества, разрушающие структурные белки, в том числе белки молодости кожи, – коллаген и эластин.
Большое заблуждение думать, что теломеры активно укорачиваются только в очень зрелом возрасте. Человек начинает довольно быстро стареть уже в 40-45 лет, то есть на том возрастном отрезке, когда считает себя еще молодым. Именно для указанного возрастного периода характерны первые значимые негативные сдвиги в деятельности сердечно-сосудистой и эндокринной систем, желудочно-кишечного тракта.
ТЕЛОМЕРАЗА И ЕЕ РОЛЬ В СОХРАНЕНИИ МОЛОДОСТИ И ЗДОРОВЬЯ
Еще в начале 1970-х гг. была выдвинута научная гипотеза о том, что в организме человека существует фермент, способный удлинять критически короткие теломеры. Позднее это предположение подтвердилось. Сегодня ученым хорошо известно о таком ферменте как теломераза, который выполняет функцию достраивания коротких теломер, буквально переводя наши биологические часы назад.
Итак, теломераза способна делать клетки моложе, а биологический возраст – ниже.
Но вместе с этим было установлено, что в большинстве клеток организма человека теломераза находится в неактивном состоянии, то есть не выполняет свою функцию.
Ответом на это открытие стала разработка специальных фармакологических препаратов – активаторов теломеразы. Однако врачам также известно, что активировать теломеразу и, следовательно, удлинять теломеры, можно и не прибегая к подобной терапии.
ОБРАЗ ЖИЗНИ КАК СПОСОБ УДЛИНЕНИЯ ТЕЛОМЕР
Удлинить теломеры, а значит снизить свой биологический возраст, продлив молодость и активное долголетие, возможно за счет здорового образа жизни, основными составляющими которого являются:
Снижая свой биологический возраст, вы улучшаете состояние клеток кожи и их реакцию на стимулирующие косметологические процедуры. Таким образом, вы получаете более выраженные и стойкие результаты от аппаратного и инъекционного омоложения.
Признавая научную обоснованность приведенных выше рекомендаций, следует понимать, что они носят общий характер. Каждый человек уникален, поэтому подход к сохранению молодости не может ограничиваться суммой пусть и полезных, но все-таки общих советов.
Выявить сотни индивидуальных рисков и тенденций, в том числе и предрасположенность к преждевременному старению позволяет генетическое тестирование. В содержание результатов генетического теста также входит широкий перечень рекомендаций по образу жизни (питание, физическая активность, прием витаминов и др.), выданных лично вам на основе расшифровки вашей уникальной генетической программы.
В рамках концепции персонализированной антивозрастной медицины «Сенсави» рекомендует наряду с анализом крови на теломеры пройти и генетическое тестирование. Чем более полной и исчерпывающей информацией будут располагать наши врачи, тем более точную и эффективную программу омоложения они для вас составят.
Продлить или вернуть молодость, в самом буквальном смысле, за счет снижения биологического возраста и эффективных косметологических процедур, – это великолепная возможность и абсолютная реальность сегодняшнего дня.
ОТСЛЕЖИВАЙТЕ ВАШИ АНТИЭЙДЖ-РЕЗУЛЬТАТЫ
Чтобы отследить длину теломер и изменения вашего биологического возраста, мы рекомендуем повторно сдать анализ крови на теломеры через полгода-год от начала антивозрастной терапии.
Теломерный тест что это
Революционный тест крови, который, как утверждают эксперты, однажды коренным образом изменит медицину, становится обычным анализом, как, например, анализ на холестерин. Это анализ измеряет длину теломер человека.
Теломеры сейчас одно из самых модных слов в медицине. Это крошечные объекты – размером в одну десятимиллионную часть метра – которыми заканчивается каждая хромосома в нашем организме. Они являются защищающими окончаниями хромосом.
Хромосомы – это структуры, которые являются домом для генетического материала наших клеток. Теломеры подобно пластиковому колпачку на конце шнурка защищая вашу ДНК расплетаться при каждом делении клетки, когда хромосомам нужно расщепиться для новой клетки.
Наши возрастные проблемы начинаются, когда теломеры укорачиваются. Это происходит при каждом копировании хромосом. Чем старше мы становимся, тем короче теломеры. Это происходит до определенного момента, когда теломеры больше не могут укорачиваться и хромосомы остаются без защищающего конца – теломеры. Начинают накапливаться ошибки в хромосомах, клетки мутируют или умирают.
Это имеет катастрофические последствия для нашего организма: у нас может развиться рак, сердечные заболевания или хронические воспалительные заболевания, как артрит и как, например, просто, раздражающие нас признаки старения – провисания кожи. Таким образом, теломеры хранят секретный ключ к болезням и старению, и, в конечном итоге, к коду нашего долголетия.
Какие преимущества дает знание длинны теломер?
Текущее состояние пациента, отвечает ли его физический возраст, возрасту теломер, позволяет рекомендовать пациенту обратить внимание на свой образ жизни.
Простое изменение образа жизни позволяет тормозить укорочение теломер. Если тест показал, что ваши теломеры укорачиваются слишком быстро, это должно стать для вас тревожным сигналом к пересмотру своего образа жизни и устранению факторов риска. Регулярные физические упражнения, правильное питание и снижение уровня стресса снижают скорость укорочения теломер, а хроническое стрессовое состояние и курение, ускоряют сокращение теломер.
Теломеры и новые мишени протоонкогенной терапии
Теломеры и новые мишени протоонкогенной терапии
Автор
Редактор
Теломеры — это не просто концы молекулы ДНК, а важный регуляторный элемент. Механизмы их удлинения представляют большой интерес для науки и медицины. Данная статья посвящена открытию новых деталей регуляции длины теломер в раковых клетках, а также потенциальному терапевтическому агенту против остеосаркомы и глиобластомы.
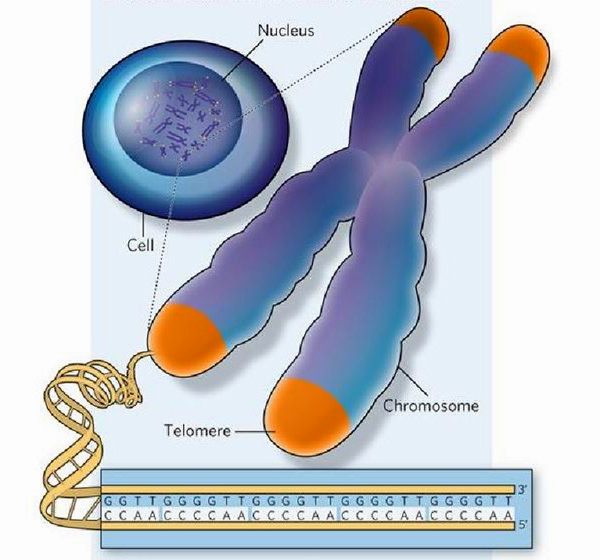
Генетический материал эукариот представлен молекулами ДНК, которые уложены определенным образом, взаимодействуя с белками и образуя хромосомы. Особенно плотно ДНК упакована во время деления клетки. В хромосомах можно выделить определенные структуры, в частности, на их концах имеются теломеры, состоящие из тандемных нуклеотидных повторов (рис. 1). У человека последовательность 5’—TTAGGG—3’ повторяется а на 3’-конце теломеры находится длинный однонитевой участок ДНК, образующий петлю. Комплекс из шести белков, связанных с теломерами, — шелтерѝн — образует защитный «колпачок», предохраняющий хромосомы от действия нуклеаз и слипания [1].
Рисунок 1. Локализация и нуклеотидная последовательность теломер. Концевые фрагменты хромосом содержат длинные нуклеотидные повторы (приведенная последовательность характерна для Tetrahymena). Эти зоны называются теломерами (показаны оранжевым) и играют важную регуляторную роль в жизни клетки. Иллюстрация с сайта www.nature.com.
Механизм удвоения генетического материала устроен так, что теломерные повторы не могут воспроизводиться полностью. Поэтому после каждого деления клетки концы хромосом укорачиваются. Когда они становятся слишком маленькими, то появляется угроза повреждения экспрессируемых участков генома: «обглоданные», уже не защищенные шелтерином, концы хромосом активируют репарацию ДНК, что приводит к различным мутациям вплоть до хромосомных аберраций. Во избежание таких нарушений «постаревшая» клетка перестает делиться. Получается, репликативное старение просто необходимо, ведь слишком большое число делений порождает множество мутаций и ведет к онкогенезу [2].
Однако описанный алгоритм в природе не универсален: длина теломерной ДНК у разных организмов (а иногда и у одного и того же) может со временем как уменьшаться, так и расти [3]. Например, раковые клетки способны делиться бесконечно. В них работают специальные механизмы для восстановления концов хромосом. Удлиняться теломеры могут двумя способами. Во-первых, с помощью специального фермента — теломеразы, который достраивает концевые повторы ДНК [4]. В нормальных клетках взрослого организма этот фермент не работает, но при патологии может активироваться. Во-вторых, существует путь удлинения концов хромосом с помощью гомологичной рекомбинации Его также называют альтернативным путем удлинения теломер — ALT (alternative lengthening of telomeres). Интересно, что такой механизм является основным в ряде опухолей, например, в остеосаркоме и глиобластоме [8]. Получается, что такие опухоли попадают в зависимость от рекомбинации, а это уже можно использовать в терапевтических целях.
Почему гомологичная рекомбинация концов ДНК становится возможной?
Молекула ДНК представляет собой двойную спираль. Когда создается копия генома для дальнейшего деления клетки, то двойная спираль частично расплетается и появляются участки одноцепочечной ДНК. Такие участки покрываются специальным белком — репликационным белком А [9], за счет чего приобретают способность к гомологичной рекомбинации. Обычно этот белок связан с теломерами временно [10, 11]. А именно — в момент синтеза дочерней цепи ДНК. Однако при патологии репликационный белок А не уходит с теломерных участков, способствуя развитию «назапланированных» рекомбинационных событий [12].
Роль некодирующей РНК в удлинении теломер
Известно, что при реализации генетической информации с ДНК считывается РНК, а с РНК — белок. Но так происходит не всегда. Наравне с молекулами РНК, кодирующими белок, синтезируются некодирующие РНК, которые выполняют разнообразные важные функции в клетке. Вот и в гомологичной рекомбинации концов хромосом без них не обошлось. Оказалось, что репликационный белок А поддерживает особая некодирующая РНК (TERRA — telomere repeat-containing RNA) [10, 13, 14, 15]. Именно ее регуляция и нарушается в раковых клетках. Обнаружили, что эту некодирующую РНК должен убирать с теломер белок ATRX — АТФ-зависимая хеликаза, ремоделирующая хроматин. Выстроилась такая последовательность событий: когда ATRX перестает правильно работать, некодирующая РНК продолжает удерживать репликационный белок А на ДНК дольше, чем необходимо, и концы ДНК становятся готовыми к удлинению [12].
Важно заметить, что просто описанной подготовки теломер недостаточно для их удлинения путем гомологичной рекомбинации. Видимо, это только один из ключевых моментов.
Прикладное значение
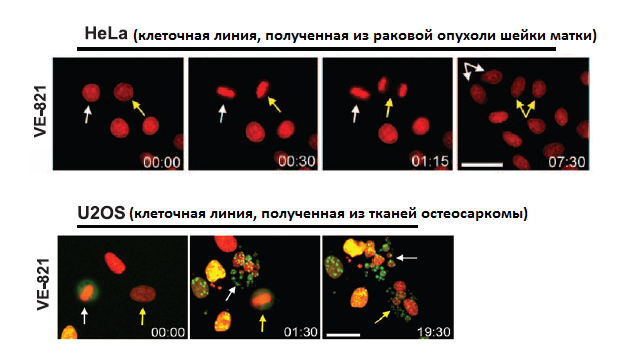
Изучать механизмы восстановления теломер интересно не только с точки зрения фундаментальной науки. Ученые разрабатывают подходы к применению таких знаний в терапии злокачественных опухолей. Проверка предположения, что ингибирование ключевых белков, ответственных за рекомбинацию, может специфично убивать раковые клетки, дала положительный результат (рис. 2).
Рисунок 2. Действие ингибитора VE-821 на клеточные линии HeLa и U2OS. Изменения фиксировались через определенные промежутки времени. Желтые и белые стрелки указывают на клетки, которые переходят в следующую фазу клеточного цикла и начинают делиться. Клетки HeLa (верхняя панель) не чувствительны к действию ингибитора, т.к. для удлинения теломер используют теломеразу, а не гомологичную рекомбинацию. Клетки остеосаркомы под действием ингибитора перестают делиться и разрушаются. Рисунок из [12], адаптирован.
Было выявлено разрушительное действие на клетки опухолей ингибитора протеинкиназы ATR, которую репликационный белок А привлекает для осуществления рекомбинации. Ингибитор VE-821 избирательно воздействовал на клетки, способные удлинять теломеры с помощью гомологичной рекомбинации. Он вызывал фрагментацию их хромосом и способствовал клеточной гибели. Интересно, что ингибитор считают безопасным для нормальных тканей. Проверка воздействия VE-821 на клетки эпителия выявила лишь замедление их деления, но не гибель. Ингибитор оказался бесполезным для предотвращения роста опухолей, в которых концы ДНК удлиняются с помощью теломеразы. Однако VE-821 эффективно блокирует деление клеток, полученных из остеосаркомы и детской глиобластомы, что авторы исследования [12] и предлагают использовать в терапевтических целях.
Артериальная гипертензия и теломеры. Драпкина О.М.
Оксана Михайловна Драпкина, профессор, доктор медицинских наук:
– Следующий доклад сделаю я, он будет посвящен теломерам и артериальной гипертензии.
Анатолий Иванович Мартынов, академик РАМН, доктор медицинских наук:
– Это очень интересная проблема, и она, я думаю, со временем будет иметь большое практическое значение. Сейчас пока это очень интересные данные науки.
Драпкина О.М.:
– Да. Занимаясь, готовясь к лекции, я поняла, что, действительно, наверное, за этим, может быть, не очень близкое, но будущее все-таки есть, и поэтому, уважаемые коллеги, позвольте начать, чтоб нам не выходить из регламента.
Итак, артериальная гипертензия и теломеры. Вот в названии доклада есть то, что хорошо изучено, это артериальная гипертензия, хотя вообще сам термин «теломеры» вносит определенную такую нотку загадочности в артериальную гипертензию, я тоже постараюсь это показать. И теломеры. Поэтому я, наверное, начну со второй части доклада и именно остановлюсь на этих структурах. Итак, что же это такое и вообще какова история развития учения о теломерах. На самом деле мы как бы предчувствовали, я имею в виду, мы – это медицинская научная общественность, предчувствовали наличие теломеров очень и очень давно, и вы видите, профессор Вейсманн, который был не то, что учеником, а последователем Дарвина, и он был основателем теории неодарвинизма, он уже считал и понимал, что определенные признаки, да практически все признаки, они наследуемые. И он считал, что есть некая субстанция в нашем организме, которая отвечает за передачу этой наследственной информации.
Остановимся очень коротко на строении и функции. В принципе, большинство учебных пособий, литературных журналов, ссылок говорят о том или дают нам такое определение: теломеры – это специализированные концевые районы линейной хромосомной ДНК, состоящей из многократно повторяющихся коротких нуклеотидных последовательностей. Надо сказать, что эти последовательности весьма консервативны, и большинство, например, позвоночных или повторы большинства позвоночных состоят из 6 нуклеотидов, пример приведен на слайде. Если говорить о насекомых, то это 5 нуклеотидов. И, наконец, растения – это 7 нуклеотидов. И вот очень коротко приблизительно фотографии и позвоночных, и растений, и насекомых, мы видим консервативные одинаковые последовательности, которые свойственны этим разным живым существам.
По поводу человека. Длина теломерных ДНК у человека колеблется от 2 до 20 тысяч пар нуклеотидных остатков. И надо сказать, что теломеры и клетка делятся, и в основном теломеры очень быстро укорачиваются в первый год жизни и после 60-70 лет, ну это понятно. Первые годы жизни – это потребности в быстром росте. А после 70 лет – это как раз тот период, когда возможное происходит укорочение теломер, и мы знаем, что, по некоторым данным, мы можем говорить о том, что человек пожилой – это после 65 лет, по рекомендациям ВОЗ. Какова же функция теломер? Основные функции представлены на данном слайде. Их, конечно, гораздо больше. Коротко остановлюсь на каждой. Механическая функция. Непосредственно теломеры прикрепляют хромосому к ядру, и это очень важно для того, чтобы клетка нормально функционировала. Стабилизационная функция – это как раз предотвращение от недорепликации тех участков, которым свойственно разорваться.
Влияние на экспрессию генов. Рядом с теломерами гены находятся в состоянии как бы транскрипционного молчания, то есть они подавлены, или в англоязычной литературе этот процесс называется «silence». Так вот как только теломеры достигают своей критической короткой величины, а это где-то 2 килобазы, то происходит активация этих генов, и они начинают включаться в работу, может быть, не всегда хорошо, но, тем не менее, они начинают действовать для того, чтобы каким-то образом сохранить клетку от гибели. Ну и, наконец, счетная функция. Совершенно неслучайно доказано, что теломеры – это часы жизни, это методические часы, и здесь важно не то количество, сколько уже делений прошла клетка, здесь важно, сколько делений теломерному участку еще осталось. Второй аспект – это теломераза, это тот фермент, который может, или которым мы можем управлять возрастом, воздействуя на который, мы можем управлять возрастом. Но, я тоже хочу показать, что здесь есть подводные камни. Не всегда омоложение ведет только к тем результатам, которые мы от него ожидаем.
Итак, теломераза – это рибонуклеопротеидный комплекс, который включает в себя три части. Это непосредственно обратная транскриптаза, вот ее портрет представлен на данном слайде; это теломерная РНК; и это белок дискерин. Я уже упоминала этих двух леди, Элизабет Блэкберн и Кэрол Грейдер, а также Джек Шостак в 2009 году были удостоены Нобелевской премии в области физиологии и медицины за открытие теломеразы и изучение механизма репликации теломер. Таким образом, как бы вот такое промежуточное резюме, что же происходит с нами в течение жизни с нашими клетками? Мы видим – хромосома, на концах теломеры, происходит процесс репликации. И в таких случаях, когда репликация, они происходят эти процессы постоянно в соматической клетке, из которой в основном состоит наш организм. Когда теломеры достигают критической величины, это ведет к гибели клетки, и это все описано, в частности, в тех сносках, которые тоже вы видите на данном слайде.
Как я уже сказала, в 1961 году Леонард Хейфлик понял, что есть определенный лимит делений, и тогда это число по Хейфлику было 50-52. Что говорят современные данные? Современные данные говорят, что в принципе нормальные клетки 70-летнего человека делятся где-то 20-30 делений, нормальные клетки новорожденных – это 80-90 делений. Еще раз напомню, что в основном делятся хромосомы, и они укорачиваются теломеры, я имею в виду, в первые годы жизни и после 70 лет. Но что важно? Раковые клетки, стволовые клетки и зародышевые клетки способны делиться бесконечно. Почему так происходит? Оказывается, теломеразы нет, она не должна быть активной, она просто как бы не существует в соматических клетках, и слава богу. Потому что, если бы она существовала в соматических клетках, то они бы делились постоянно и приобретали бы черты атипичности, а именно – раковых клеток.
И вот мы видим таблицу сводную, здесь представлены половые клетки, соматические клетки и раковые клетки. Здесь как бы показано число нуклеотидных последовательностей в теломере. Мы видим, что соматические клетки, они нас, конечно, интересуют больше всего, это число 10-20, и после рождения с возрастом они уменьшаются, и мы видим, что теломеразная активность отсутствует. Так вот попытки усилить активность теломеразы в соматических клетках могут обернуться очень неприятными последствиями. В частности, например, перерождение в некоторых клетках в раковые. Соответственно, к омоложению, к различным способам омоложения, – ну я сейчас говорю, конечно, используя системы теломеров, их теломеразной активности, – нужно относиться со здравым смыслом и, наверное, не пытаться полностью старость предать забвению, потому что в старости есть очень много позитивного. И, наконец, то, о чем я в основном и должна сказать, это теломеры и гипертоническая болезнь.
Почему вообще ученые занялись этой проблемой? Это совершенно очевидно. Гипертоническая болезнь, артериальная гипертензия с возрастом нарастает. И мы знаем, даже есть такой термин у нас, это гипертония пожилых или изолированная систолическая гипертензия. В то же время, есть определенная связь, обратная связь между длиной теломер и возрастом человека. И поэтому вот эти сопоставления привели к серии блестящих экспериментов, некоторые из которых я позволю себе процитировать.
Итак, в 2006 году появилась работа профессора Риверо и соавторов, которая оценивала влияние дефицита теломеразы и укорочение теломер на артериальное давление в эксперименте у мышей. Вы видите, уважаемые коллеги, что было взято три типа мышей – это мыши дикого типа, и дальше мы будем вот эту аббревиатуру употреблять, WT; мыши с отсутствием активности теломеразы и без значительного сокращения теломер, G1; и мыши с лишенной активностью теломераз и со значительным укорочением теломер, или G3. Возраст мышей составил 6 месяцев. Что оказалось? Когда стали прицельно рассматривать течение артериальной гипертензии, то мыши группы G1 показали увеличение уровня систолического давления по сравнению с мышами дикого типа. А вот как раз больший интерес вызвала группа G3, то есть это мыши без теломеразы и с очень короткими теломерами. У них повышалось как систолическое, так и диастолическое артериальное давление. Когда посмотрели роль вазоактивных эндотелиальных факторов в генезе артериальной гипертензии, то оказалось, что все типы совершенно одинаково отвечают на ангиотензин-II, на ингибиторы ангиотензина– II, что, в общем, говорило о том, что, наверное, больше эндотелиновая система вносит вклад в измерение и в укорочение теломер. И действительно, например, при лечении бозентаном показатели среднего артериального давления снизились как раз в группе мышей G3, которым больше всего была свойственна низкая теломеразная активность и высокое артериальное давление.
Следующий эксперимент, в 2000 году стала доступна эта публикация, исследователи выясняли связь между уровнем артериального давления, пульсового давления и длиной теломер. Были исследованы 98 здоровых близнецов, их было 49 пар, им было от 18 до 44 лет, и это были как раз теломеры лейкоцитов, то есть предмет исследования. В этом исследовании была выявлена взаимосвязь между длиной теломер и величиной пульсового давления, вот эта связь прослеживается, вы ее видите. Соответственно, пульсовое давление и теломеры – это очень важная как бы связка, которая была доказана в данном исследовании. Далее последовала череда экспериментальных работ, которые попытались связать окислительный стресс и длину теломер. Ведь очень много есть теорий старений, и одна из теорий старения – это активация как раз свободно-радикального окисления. И профессор Демиссе и соавторы тоже исследовали 327 мужчин 62 лет и установили, что длина теломер обратно коррелирует с возрастом, это как бы очевидно, но длина теломер обратно коррелировалась ХОМА-тестом и с уровнем глюкозы. Они немножко так шуточно сказали, что, в общем-то, чтобы дольше жить, надо меньше есть. Но здесь, конечно, мы должны к этому относиться с определенными оговорками. При сравнении участников исследования с их сверстниками, у которых не повышалось артериальное давление, было показано, что длина теломер у гипертоников статистически значимо короче, чем длина теломер у таких же сверстников, без артериальной гипертензии. И коротко два последних исследования.
Связь между длиной теломер, лейкоцитов и факторами риска сердечно-сосудистых заболеваний, в 2007 году 419 человек в это исследование внесено. Была установлена обратная корреляция между длиной теломер и лейкоцитов, и риском развития сахарного диабета, и инсулинорезистентностью. И вот что важно? Оказалось, что у молодых участников, то есть у тех, у кого теломеры не должны бы уменьшиться, каждое сокращение теломеры на тысячи нуклеотидов, это одна килобаза, ассоциируется с тройным увеличением риска инфаркта миокарда и инсульта. И когда посмотрели на гендерные различия, оказалось, что все-таки большей ассоциации длина теломер с показателями, например, распространенности, распространения пульсовой волны и пульсовым давлением имеет у мужчин, а не у женщин. И вообще, у мужчин и женщин одинакового возраста длина теломер у женщин была больше и, соответственно, их, получается, биологический возраст был несколько меньше, чем у мужчин. Вот я демонстрирую эти связи, мы видим, длина теломер, возраст, есть совершенно определенная связь и у мужчин, и у женщин. Мы видим взаимосвязь между скоростью пульсовой волны и длиной теломер, у мужчин более тесная связь, чем у женщин. И, наконец, практически прямая линия между длиной теломер и величиной пульсового давления у женщин, а у мужчин все-таки эта зависимость прослеживается.
Почему для нас это важно? Это важно, потому что и скорость распространения пульсовой волны, и пульсовое давление сейчас рассматриваются как серьезные предикторы выживаемости. Ну, например, риск развития инсульта у больных с изолированной систолической гипертензией, тогда, когда есть большое пульсовое давление, в несколько раз выше. И мы тоже знаем, что с возрастом удельный вес пациентов с изолированной систолической гипертензией увеличивается. Почему? Первое объяснение, и уже тому есть много предпосылок, это фиброз сосудов. Но фиброз сосудов не может происходить без, например, фиброза сердца, и поэтому вопрос о том, что же запускает, периферия ли ведет к фиброзу кардиомиоцитов или же непосредственно жесткое сердце, нарушенная диастола уже в свою очередь ведет к жесткой периферии, все еще остается вопросом. Спутником пожилого человека является коморбидность, это и инсульт, и хроническая сердечная недостаточность, и неалкогольная жировая болезнь печени.
И вот мы проанализировали таких пациентов, коморбидных, тучных, с метаболическим синдромом, с выраженными процессами фиброза, и продемонстрировали, что снижение уровня артериального давления ассоциируется с лучшим, естественно, прогнозом. Понятно, что вот в этом исследовании, которое называлось «Дирижер», в качестве основной антигипертензивной терапии мы использовали лизиноприл, диротон и ко-диротон. Это как бы тоже совершенно закономерно, что комбинированная терапия приводила к большему снижению и систолического, и диастолического артериального давления. Но что вот очень было важно в этом исследовании «Дирижер», – мы увидели, что на фоне применения лизиноприла снижалась как бы предуготованность миокарда к фиброзу. Это мы увидели по соотношению пика Е/е´, которое очень точно, на сегодняшний день, во всяком случае, характеризует диастолическую дисфункцию. Поэтому ингибиторы АПФ, диротон, лизиноприл, естественно, для пульсового давления он крайне хорош. Мы не знаем, как действуют препараты на длину теломер пока еще. Но есть определенные предположения, что они должны действовать. Поэтому пока мы можем сделать такую общую схему. Итак, факторы риска, все факторы риска сердечно-сосудистых заболеваний, уменьшение длины теломер, увеличение пульсового давления, это ведет к увеличению риска сердечно-сосудистых осложнений, и вот оно, снижение жизни наших пациентов.
Позвольте остановиться на выводах. Изучение активности теломеразы и длины теломер позволит разработать современные подходы к лечению, это актуально. И как раз исследование этих механизмов и функций, наверное, сейчас крайне перспективно. И вообще анализ этой темы, вот, например, меня привел к тому, что не надо искусственно молодеть, а надо наслаждаться каждым возрастом. В старости тоже есть очень много положительного. В частности, мне очень понравились работы Дейн Денгел, которая показывает вот эту хорошую добрую счастливую старость. Многие исследователи считают, что старостью надо называть не старость, а это всего лишь поздняя взрослость. Спасибо за внимание.