У новорожденного низкая глюкоза что это значит
У новорожденного низкая глюкоза что это значит
Гипогликемия — типичная проблема у новорождённых, однако у детей после этого периода встречается намного реже. Она обычно определяется при концентрации глюкозы в плазме менее 2,6 ммоль/л, хотя развитие клинических признаков будет зависеть от того, насколько могут использоваться другие источники энергии. Клинические признаки включают:
• повышенное потоотделение;
• бледность;
• признаки раздражения ЦНС, в том числе головную боль, судороги и кому. Неврологические последствия могут быть перманентными, если гипогликемия сохраняется, и включают эпилепсию, выраженные сложности в обучении и микроцефалию. Риск максимально высок в раннем детском возрасте, в период наиболее интенсивного развития головного мозга.
У детей имеются высокие энергетические потребности и относительно небольшие резервы глюкозы вследствие глюконеогенеза и глюкогенеза. Они имеют риск гипогликемии натощак. Младенцы никогда не должны голодать более 4 ч, например, в предоперационном периоде. Необходимо проверить уровень глюкозы в крови у тех детей, которые:
• имеют признаки септицемии или выглядят серьёзно больными;
• у которых наблюдаются продолжительные судорожные припадки;
• у которых развивается нарушение сознания. Это часто производится у постели пациента с использованием полосок, чувствительных к глюкозе, точность которых увеличивается при использовании глюкометра. Однако полоски только указывают на то, что уровень глюкозы находится в пределах низкого диапазона значений и любое указание на низкое значение должно всегда проверяться лабораторным измерением.
Если причина гипогликемии не установлена, жизненно важно производить забор крови во время гипогликемии. Кроме того, первая полученная порция мочи направляется для анализа, для того чтобы не упустить ценную возможность для установления диагноза.
Исследования, которые необходимо провести при наличии гипогликемии:
• Кровь:
— Подтверждение гипогликемии лабораторным исследованием содержания глюкозы в крови.
— Определение содержания ГР, кортизола, инсулина, С-пептида, жирных кислот, ацетоацетата, 3-гид-роксибутирата, глицерина, аминокислот с разветвлёнными цепями, ацетилкарнитинового профиля, лактата, пирувата.
• Первая моча после гипогликемии:
— Определение содержания органических кислот.
— Рассмотреть возможность сохранения крови и мочи для токсикологического анализа, например, салицилатов, сульфонилурии.
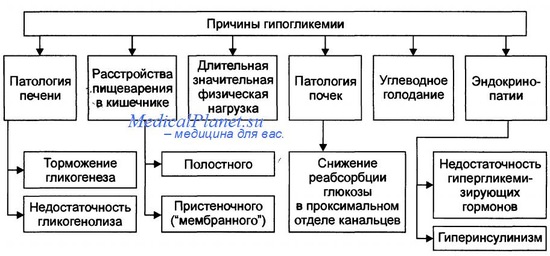
Причины гипогликемии после неонатального периода:
• Голодание
• Избыток инсулина:
— Избыточное экзогенное поступление инсулина, например, при сахарном диабете (скрытое поступление инсулина).
— Опухоли / повышение функции b-клеток — ПГГМ (ранее называемый гиперплазией островковых клеток поджелудочной железы), инсулинома.
— Индуцированный приёмом лекарственных препаратов.
— Аутоиммунный (антитела к рецепторам инсулина).
— Синдром Беквита (синдром висцеромегалии и офтальмоцеле).
• Без гиперинсулинемии:
— Заболевания печени.
— Кетотическая гипогликемия детского возраста.
— Врождённые нарушения метаболизма, например, нарушения накопления гликогена.
— Гормональный дефицит: ГР, АКТГ, болезнь Аддисона, врождённая гиперплазия надпочечников.
• Реактивная (не в результате голодания):
— Галактоземия.
— Чувствительность к лейцину.
— Непереносимость фруктозы.
— Материнский диабет.
— Гормональный дефицит.
— Отравление аспирином / алкоголем.
P.S. АКТГ — адренокортикотропный гормон. ГР — гормон роста. ПГГМ — персистирующий гипогликемический гиперинсулинизм младенцев.
Кетотическая гипогликемия — плохо определяемое понятие, при котором у маленьких детей появляется склонность к гипогликемии после короткого периода голодания, возможно, вследствие ограниченных резервов для глюконеогенеза. Ребёнок часто невысокого роста и худой, уровень инсулина у него низкий. Регулярные лёгкие закуски и напитки с дополнительной глюкозой при болезни обычно могут предотвратить гипогликемию. Это состояние проходит само собой в дальнейшей жизни.
Некоторые редкие эндокринные и метаболические нарушения могут проявляться гипогликемией практически в любом возрасте у детей. Гепатомегалия заставляет подозревать возможность врождённого нарушения накопления гликогена, при котором может быть выраженная гипогликемия.
Персистирующий гипогликемический гиперинсулинизм младенцев (ПГГМ), который ранее назывался гиперплазией островковых клеток поджелудочной железы) — редкое заболевание в младенчестве, при котором имеется мутация ионных каналов, приводящая к нарушению регуляции выброса инсулина островковыми клетками поджелудочной железы, что приводит к выраженной не-кетотической гипогликемии.
Лечение гипогликемии у детей
Гипогликемию обычно можно скорректировать внутривенной инфузией глюкозы (2-4 мл/кг 10% декстрозы). Необходимо предпринять меры по избеганию введения избыточного объёма, поскольку раствор является гипертоническим. Если происходит задержка начала инфузии или отсутствует ответная реакция, внутримышечно вводится глюкагон (0,5-1 мг).
Глюкокортикоиды могут также применяться, если есть вероятность гипопитуитаризма или гипоадренализма. Коррекция гипогликемии всегда должна быть документирована с удовлетворительными результатами лабораторного анализа глюкозы.
Гипогликемия:
• Должна быть исключена у любого ребёнка с септицемией, находящегося в тяжёлом состоянии, в продолжительном эпилептическом припадке или при нарушении уровня сознания.
• Низкий уровень глюкозы крови при тестировании возле кровати пациента (тест-полосками) должен быть подтверждён лабораторными данными.
• Если причина неизвестна, необходимо произвести забор диагностических образцов крови и мочи, если возможно, одновременно.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Причины снижения уровня глюкозы в крови
| Статья подготовлена Михаилом Астаховым, врач анестезиолог-реаниматолог, высшей категории. Специально для сайта medprostor.by |
Содержание:
Гипогликемия — понижение сахара в крови. Симптомы развиваются постепенно, в течение 20-60 минут. Встречается преимущественно у лиц, страдающих сахарным диабетом I типа (инсулинозависимый) при нарушении правил заместительной терапии. Иногда возникает у беременных женщин или новорожденных детей. Минимальным приемлемым показателем глюкозы крови считается 3,3 ммоль/л. При декомпенсированном СД симптомы падения сахара в крови у человека возникают уже при 4,5 ммоль/л. В самых тяжелых случаях явления гипогликемии могут отмечаться при 6-7 ммоль/л.
Клинические признаки понижения уровня глюкозы
Падение сахара в крови, независимо от причин, имеет симптомы:
снижение интеллектуальных способностей;
туман, мушки перед глазами;
резкое, неудержимое чувство голода.
При осмотре пациента обнаруживается потливость, скачок артериального давления, тахикардия, бледность кожи. При возникновении гипогликемической комы — нарушение дыхания, сознания, сердечного ритма.
Причины снижения сахара в крови
Наиболее распространенная причина понижения глюкозы в крови — отсутствие приема пищи после инъекции инсулина у пациентов, страдающим сахарным диабетом. На долю подобных случаев приходится около 90% всех эпизодов диагностированной гипогликемии. Гормон, попадая в кровоток, способствует расщеплению и усвоению углеводов тканями. При этом их плазменный уровень критически снижается. Признаки патологии возникают при резком падении уровня сахаров с высоких цифр до низких или нормальных для здорового человека показателей (например, с 18-19 до 5-6 ммоль/л у диабетиков).
К числу других возможных причин резкого падения сахара в крови у пациентов с СД относится:
Гипогликемия у новорожденных
Причины снижения сахара в крови у детей начального периода жизни:
синдром новорожденного от матери, страдающей классическим или гестационным диабетом;
ятрогенная неонатальная гипогликемия;
другие преходящие и неуточненные нарушения углеводного обмена.
Подобные нарушения обусловлены особенностями выработки и потребления сахаров организмом ребенка. Потребление глюкозы в раннем постнатальном периоде составляет около 7 г/кг веса в сутки. Недостаточное ее поступление провоцирует активизацию процессов гликогенолиза и глюкогеногенеза, что в дальнейшем может иметь непредсказуемые последствия.
Гипогликемия у здорового человека
Порой сахар в крови падает у беременных. Это обусловлено гормональной перестройкой организма, при которой возникает гиперпродукция инсулина поджелудочной железой. Кроме того, причиной низкого сахара в крови у женщины может быть недостаточность питания. Плод потребляет достаточно большое количество глюкозы. Если расход не компенсируется за счет пищи, концентрация сахаров во внутренней среде снижается.
У людей без сахарного диабета причиной гипогликемии становится инсулинома — гормонопродуцирующая опухоль поджелудочной железы. При этом концентрация инсулина в организме увеличивается, содержание сахаров снижается. Иногда падение уровня глюкозы возникает при экстремальном голодании, когда организм оказывается неспособен компенсировать недостаток углеводов за счет внутренних резервов.
Гипогликемическое состояние у детей
Редкий случай органического гиперинсулинизма у ребенка 3 месяцев Уровень глюкозы в крови натощак у практически здорового человека колеблется от 3,3 до 5,5 ммоль/л при определении глюкозооксидазным методом.
Редкий случай органического гиперинсулинизма у ребенка 3 месяцев
Уровень глюкозы в крови натощак у практически здорового человека колеблется от 3,3 до 5,5 ммоль/л при определении глюкозооксидазным методом. На протяжении суток глюкоза в плазме крови в норме может колебаться от 2,8 до 8,8 ммоль/л. Содержание глюкозы в крови ниже 2,7 ммоль/л принято называть гипогликемией.
Основная причина гипогликемического симптомокомплекса — гиперинсулинизм.
Гиперинсулинизм — патологическое состояние организма, обусловленное абсолютным или относительным избытком инсулина, вызывающим значительное снижение содержания сахара в крови; как следствие возникают дефицит глюкозы и кислородное голодание мозга, что ведет к нарушению в первую очередь высшей нервной деятельности.
Абсолютный гиперинсулинизм — это состояние, связанное с патологией инсулярного аппарата (первичный органический гиперинсулинизм). Наиболее частыми причинами органического гиперинсулинизма являются инсулинома — опухоль b-клеток островков Лангерганса, секретирующая избыточное количество инсулина (у взрослых и детей старшего возраста) и незидиобластоз — гиперплазия островков поджелудочной железы (у детей первого года жизни). Еще одна нередкая причина гиперинсулинизма у детей младшего возраста — функциональный гиперинсулинизм новорожденных от матерей с сахарным диабетом.
Доброкачественную аденому островков Лангерганса впервые обнаружил в 1902 году во время вскрытия Николлс. В 1904 году Л. В. Соболев описал «струму островков Лангерганса». В 1924 году Гаррис и отечественный хирург В. А. Оппель независимо друг от друга описали симптомокомплекс гиперинсулинизма. В этом же году Г. Ф. Ланг наблюдал множественный аденоматоз панкреатических островков. В России успешная операция удаления инсулиномы была выполнена в 1949 году А. Д. Очкиным, а в 1950 году — О. В. Николаевым. Инсулин-секретирующая опухоль описана во всех возрастных группах, от новорожденных до престарелых, однако чаще она поражает людей трудоспособного возраста — от 30 до 55 лет. Среди общего числа больных дети составляют всего около 5%. 90% инсулином — доброкачественные. Около 80% из них — солитарные. В 10% случаев гипогликемия обусловлена множественными опухолями, 5% из них — злокачественные, а 5% составляет незидиобластоз (Антонов А. В. Клиническая эндокринология, 1991).
Термин незидиобластоз введен Г. Лейдло в 1938 году. Незидиобластоз — это тотальная трансформация протокового эпителия поджелудочной железы в b-клетки, продуцирующие инсулин. У детей первого года жизни это наиболее частая причина органического гиперинсулинизма (лишь 30% гиперинсулинизма у детей обусловлено инсулиномой, 70% — незидиобластозом). Это генетически обусловленное заболевание.
Диагноз устанавливается только морфологически после исключения инсулиномы. Клинически он проявляется тяжелыми, трудно поддающимися коррекции гипогликемиями, вследствие чего при отсутствии положительного эффекта от консервативного лечения придется прибегать к уменьшению массы ткани поджелудочной железы. Общепринятый объем операции — 80 — 95% резекции железы.
Инсулиномы у детей встречаются исключительно редко и располагаются либо в хвосте, либо в теле поджелудочной железы. Их диаметр колеблется от 0,5 до 3 см. Малые размеры инсулином создают сложности для диагностики (информативность УЗИ-метода — не более 30%). Для определения локализации инсулиномы применяют селективную ангиографию, КТ и МРТ или сканирование с изотопом октреотида (аналог соматостатина). Наиболее информативной является ангиография с селективным забором крови из вен поджелудочной железы (60 — 90%).
Инсулинома проявляется более или менее резким падением уровня сахара крови, что обусловлено повышенной секрецией инсулина в кровь. Радикальным методом лечения инсулиномы является хирургический (инсулиномэктомия ), прогноз в большинстве случаев благоприятный (88 — 90%) при своевременном оперативном вмешательстве.
Органический гиперинсулинизм (инсулинома, незидиобластоз) является причиной тяжелых панкреатических гипогликемий с падением сахара крови до 1,67 ммоль/л и ниже (во время приступа). Эти гипогликемии всегда некетотические (ацетон в моче отрицательный за счет подавления процессов липолиза).
Наиболее часто в клинической практике встречаются кетотические гипогликемии (с ацетонурией). Кетотические гипогликемии являются внепанкреатическими и могут быть эндокринно- и неэндокриннозависимыми. Они сопровождаются относительным гиперинсулинизмом, то есть не связанным с патологией инсулярного аппарата поджелудочной железы (вторичный, функциональный, симптоматический гиперинсулинизм). Относительный гиперинсулинизм обусловлен повышением чувствительности организма к нормально выделяемому b-клетками панкреатических островков инсулину или нарушением компенсаторных механизмов, участвующих в регуляции углеводного обмена и в инактивации инсулина.
Эндокриннозависимые кетотические гипогликемии (без повышения уровня инсулина в крови) выявляются при недостаточности контринсулиновых гормонов у больных с гипофункцией передней доли гипофиза (церебрально-гипофизарный нанизм, изолированный дефицит СТГ, гипопитуитаризм), щитовидной железы (гипотиреоз), коры надпочечников (болезнь Аддисона).
Без повышения уровня инсулина могут протекать внепанкреатические гипогликемии, встречающиеся при экстрапанкреатических опухолях (грудной клетки, брюшной полости, ретроперитонеальные и т. д.), гипогликемии, сопровождающие диффузные заболевания печени, хроническую почечную недостаточность. У детей первого года жизни причиной кетотических неэндокринозависимых гипогликемий (без гиперинсулинизма) являются врожденные энзимопатии (гликогенозы).
В клинической практике часто встречаются реактивные гипогликемии — функциональный гиперинсулинизм при вегетососудистой дистонии. Они наблюдаются у лиц с ожирением, у детей-невротиков дошкольного возраста на фоне ацетонемических рвот из-за нарушения процессов глюконеогенеза и т. д.
Нередки также гипогликемии экзогенной природы (вызванные введением инсулина, сахароснижающих средств, салицилатов, сульфаниламидов и других лекарственных средств).
При функциональном гиперинсулинизме гипогликемии клинически менее выражены, содержание сахара крови не падает ниже 2,2 ммоль/л.
Обнаружить гипогликемию можно по клиническим признакам, чаще же сниженный уровень сахара в крови является лабораторной находкой. Достоверным считается выявление гипогликемии в ранние утренние часы или натощак перед завтраком в капиллярной крови не менее 2 — 3 раз (при отсутствии четких клинических данных). Показанием для обследования в стационаре является классическая клиника гиперинсулинизма или трижды подтвержденная утренняя гипогликемия (без клинических проявлений) ниже возрастных показателей (снижение гликемии натощак для новорожденных — менее 1,67 ммоль/л, 2 месяца — 18 лет — менее 2,2 ммоль/л, старше 18 лет — менее 2,7 ммоль/л).
Для гипогликемической болезни патогномоничной является триада Уиппла:
Большинство симптомов гипогликемии обусловлено недостаточным снабжением центральной нервной системы глюкозой. При снижении уровня глюкозы до гипогликемии включаются механизмы, направленные на гликогенолиз, глюконеогенез, мобилизацию свободных жирных кислот, кетогенез. В этих процессах участвуют в основном 4 гормона: норадреналин, глюкагон, кортизол, гормон роста. Первая группа симптомов связана с повышением в крови содержания катехоламинов, что вызывает слабость, тремор, тахикардию, потливость, беспокойство, чувство голода, побледнение кожных покровов. Симптомы со стороны ЦНС (симптомы нейрогликопении) включают головную боль, двоение в глазах, нарушение поведения (психическое возбуждение, агрессивность, негативизм), в дальнейшем наступает потеря сознания, появляются судороги, может развиться кома с гипорефлексией, поверхностным дыханием, мышечной атонией. Глубокая кома ведет к смерти или необратимым повреждениям ЦНС. Частые приступы гипогликемии приводят к изменению личности у взрослых, снижению интеллекта у детей. Отличие симптомов гипогликемии от настоящих неврологических состояний — положительный эффект приема пищи, обилие симптомов, не укладывающихся в клинику.
Наличие выраженных нервно-психических нарушений и недостаточная осведомленность врачей о гипогликемических состояниях часто приводят к тому, что вследствие диагностических ошибок больные с органическим гиперинсулинизмом длительно и безуспешно лечатся под самыми разными диагнозами. Ошибочные диагнозы ставятся у 3/4 больных с инсулиномой (эпилепсия диагностируется в 34% случаев, опухоль головного мозга — в 15%, вегетососудистая дистония — в 11%, диэнцефальный синдром — в 9%, психозы, неврастения — 3% (Dizon A. М., 1999).
Период острой гипогликемии — это результат срыва контринсулярных факторов и адаптационных свойств ЦНС.
Чаще всего приступ развивается в ранние утренние часы, что связано с продолжительным ночным перерывом в приеме пищи. Обычно больные не могут «проснуться» из-за различного рода расстройств сознания. Может быть вялость, апатия по утрам. Наблюдаемые у этих больных эпилептиформные припадки отличаются от истинных большей продолжительностью, хориоформными судорожными подергиваниями, гиперкинезами, обильной нейровегетативной симптоматикой. Распознавание заболевания требует тщательного изучения анамнеза и внимательного наблюдения за больными. Это особенно важно для диагностики органического гиперинсулинизма как причины гипогликемии у детей.
У детей первого года жизни клинически выявить гипогликемию сложно, так как симптомы нечетки и нетипичны. Это может быть цианоз, бледность кожных покровов, снижение мышечного тонуса, остановка дыхания (апноэ), тремор, судороги, «закатывание» глазных яблок (нистагм), беспокойство. При врожденной форме (незидиобластоз) наблюдается большая масса тела (крупный плод), отечность, круглое лицо.
У детей дошкольного и школьного возраста с органическим гиперинсулинизмом чаще регистрируется доброкачественная инсулинома. Для этих детей характерны утренняя неработоспособность, трудности утреннего пробуждения, нарушение концентрации внимания, выраженные чувство голода, тяга к сладкому, негативизм, сердцебиения. Гиперинсулинизм приводит к повышению аппетита и ожирению. Чем моложе ребенок, тем больше выражена склонность к низкому сахару крови в ответ на более продолжительные перерывы между приемами пищи.
Среди лабораторных показателей при подозрении на органический гиперинсулинизм (инсулиному или незидиобластоз) особое место занимает исследование иммунореактивного инсулина (ИРИ). Но, как показала практика, далеко не всегда при доказанной инсулиноме имеются повышенные его значения. ИРИ принято оценивать одновременно с уровнем гликемии. Важным является индекс отношения инсулина к глюкозе — ИРИ мкед/мл/глюкоза венозная ммоль/л. У здоровых людей и на фоне гипогликемии без гиперинсулинизма этот индекс составляет менее 5,4.
Среди функциональных проб, используемых для диагностики органического гиперинсулинизма, наиболее распространена проба с голоданием.
Проба основана на развитии гипогликемии у людей с гиперфункцией инсулярного аппарата поджелудочной железы при прекращении поступления углеводов с пищей. Во время проведения пробы больному разрешается пить только воду или чай без сахара. Чем младше ребенок и чем чаще приступы гипогликемии, тем проба короче.
Длительность пробы:
дети до 3 лет — 8 ч;
2 — 10 лет — 12-16 ч;
10 — 18 лет — 20 ч;
старше 18 лет — 72 ч.
(рекомендации кафедры детской эндокринологии РМАПО, Москва).
У детей 2 лет и старше последний прием пищи должен быть накануне вечером; детям до 2 лет пробу начинают в ранние утренние часы.
У здорового человека ночное, а также более продолжительное по времени голодание умеренно снижает уровень гликемии и, что характерно, уменьшает содержание инсулина в крови. При наличии опухоли, постоянно продуцирующей избыточное количество инсулина, в условиях голодания создаются предпосылки для развития гипогликемии, поскольку поступления глюкозы из кишечника нет, а печеночный гликогенолиз блокирован опухолевым инсулином.
Перед началом пробы определяют содержание глюкозы в плазме крови. Далее гликемия в капиллярной крови (глюкометром) исследуется у детей до 2 лет 1 раз в час, у детей в возрасте 2 лет и старше — 1 раз в 2 часа. При снижении сахара в крови до 3,3 ммоль/л и меньше интервалы исследования сокращаются в 2 — 3 раза. Порог допустимой гликемии, при котором голодание прекращают и проводят исследования, — 1,7 ммоль/л у ребенка до 2 лет, 2,2 ммоль/л у детей старше 2 лет. После регистрации глюкометром пороговой гипогликемии исследуется сыворотка крови на содержание ИРИ и контринсулиновых гормонов, глюкоза крови исследуется биохимическим методом (поскольку после снижения уровня глюкозы до 3,3 ммоль/л и ниже глюкометр дает неточный результат), исследуется уровень липидов крови.
Купируется приступ гипогликемии введением в/в струйно 40% глюкозы; сразу после введения глюкозы и через 3 часа после окончания пробы исследуется моча на содержание кетоновых тел.
Интерпретация результатов пробы
В случае подтверждения гиперинсулинизма как причины гипогликемии необходимо дообследование и лечение в специализированном эндокринологическом отделении.
Во всех случаях инсулином показано хирургическое лечение. При незидиобластозе терапия может быть консервативной и радикальной. Наибольшее признание в настоящее время получил препарат диазоксид (прогликем, зароксолин). Гипергликемизирующий эффект этого недиуретического бензотиазида основан на торможении секреции инсулина из опухолевых клеток. Рекомендуемая доза для детей — 10 — 12 мг на кг массы тела в сутки в 2 — 3 приема. При отсутствии выраженной положительной динамики показано оперативное лечение — субтотальная или тотальная резекция поджелудочной железы (с возможным переходом в сахарный диабет).
С. А. Столярова, Т. Н. Дубовая, Р. Г. Гарипов
С. А. Мальмберг, доктор медицинских наук
В. И. Широкова, кандидат медицинских наук
ДКБ №38 ФУ «Медбиоэкстрем» при МЗ РФ, Москва
Больной Захар З., 3 мес., поступил в отделение психоневрологии ДКБ № 38 ФУ «Медбиоэкстрем» Москвы 01.11.02 с направляющим диагнозом эпилепсия.
Ребенок с умеренно отягощенным перинатальным анамнезом. Беременность у матери первая, протекала с токсикозом в первой половине, анемией. Роды на 40-й неделе, крупный плод (вес при рождении 4050 г, длина 54 см). Оценка по шкале Апгар — 8/9 баллов. С периода новорожденности до 2 мес. периодически отмечался тремор подбородка, с 2-месячного возраста появились приступообразные состояния в виде остановки взора, снижения двигательной активности, подергивания правой половины лица, правой руки (приступы фокальных судорог) — по несколько секунд 3 — 4 раза в сутки. Лечился амбулаторно у невропатолога, получал противосудорожную терапию без выраженного положительного эффекта. Накануне госпитализации появились хореиформные подергивания в утренние часы на фоне нарушенного сознания. Госпитализирован в отделение психоневрологии с направляющим диагнозом эпилепсия.
При поступлении состояние ребенка средней тяжести. В соматическом статусе — кожные покровы с проявлениями атопического дерматита, зев чистый, в легких хрипов нет, тоны сердца звучные, тахикардия до 140 — 160 уд. в мин. Живот мягкий, печень +2 см, селезенка +1 см. Мочеиспускание не нарушено. В неврологическом статусе — вялый, взгляд фиксирует, голову удерживает плохо. ЧН — интактны, мышечный тонус снижен, больше в руках, симметричный. Сухожильные рефлексы невысокие, Д=С, безусловные рефлексы н/р — по возрасту. Вес — 7 кг, рост — 61 см (отмечается избыток веса на фоне средневозрастного показателя роста).
В стационаре при исследовании биохимического анализа крови натощак впервые выявлено снижение сахара в крови до 1,6 ммоль/л при отсутствии кетоновых тел в моче.
Результаты лабораторного и инструментального обследования:
Динамический контроль уровня глюкозы позволил выявить стойкую гипогликемию в капиллярной и венозной крови. Натощак и через 2 часа после кормления грудным молоком в течение суток гликемия колебалась от 0,96 до 3,2 ммоль/л. Клинически гипогликемия проявлялась повышенным аппетитом, вялостью, тахикардией, эпизодами «закатывания» правого глазного яблока, генерализованными эпилептиформными судорогами. В межприступный период самочувствие удовлетворительное. Гипогликемические состояния купировались приемом глюкозы внутрь, а также внутривенным введением 10%-ной глюкозы.
С диагностической целью для подтверждения гиперинсулинизма ребенку проведена проба с голоданием: последнее ночное кормление в 6 часов утра, перед кормлением гликемия — 2,8 ммоль/л, через 3,5 часа после кормления глюкометром отмечено снижение уровня гликемии до 1,5 ммоль/л (ниже допустимого порогового значения). На фоне гипогликемии взята сыворотка крови для гормонального исследования (ИРИ, с-пептид. кортизол, СТГ). Сделан забор венозной крови для биохимического исследования уровня глюкозы и липидов. После купирования гипогликемии в/в струйным введением глюкозы собрана трехчасовая порция мочи на содержание кетоновых тел.
Результаты пробы: ацетонурии нет. Уровень контринсулиновых гормонов не снижен (кортизол — 363,6 при норме 171 — 536 нмоль/л, СТГ — 2,2 при норме 2,6 — 24,9 мкЕ/мл). С-пептид — 0,53 при норме — 0,36 — 1,7 пмоль/л. ИРИ — 19,64 при норме — 2,6 — 24,9 ммкЕ/мл. Глюкоза венозная — 0,96 ммоль/л. Уровень липидов крови на нижней границе нормы (триглицериды — 0,4 ммоль/л, холестерин общ. — 2,91 ммоль/л, холестерин липопр. выс. плотн. — 1,06 ммоль/л, холест. липопр. низк. плотн. — 1,67 ммоль/л. Индекс ИРИ/глюкоза (19,64 /0,96) составил 20,45 при норме менее 5,4.
Данные анамнеза, динамического наблюдения, клинико-лабораторного обследования позволили поставить диагноз: некетотическая гипогликемия. Гиперинсулинизм. Незидиобластоз?
Для уточнения генеза заболевания и тактики лечения ребенок переведен в эндокринологическое отделение РДКБ Москвы, где инсулинома у мальчика исключена. Подтвержден диагноз незидиобластоз. Назначено пробное консервативное лечение прогликемом в дозе 10 мг на кг массы тела. Отмечена тенденция к нормализации показателей углеводного обмена. Планируется дальнейшее динамическое наблюдение для коррекции тактики лечения.
Рассмотренный клинический случай диктует необходимость исследования показателей углеводного обмена у всех детей раннего возраста с судорожным синдромом, ввиду стертости клинических симптомов гипогликемии у детей грудного и раннего детского возраста, для исключения диагностических ошибок.