беременность после пересадки костного мозга
Беременность после пересадки костного мозга
Доктор Питер
Трудно лечится у взрослых и лишает жизнь радостей? Мифы от правды при раке крови отделила врач НМИЦ онкологии
Всероссийский центр изучения общественного мнения (ВЦИОМ) накануне представил результаты исследования «Рак крови: что мы знаем о нем и в чем заблуждаемся?». Социологи опросили 1600 россиян, предложив им несколько суждений о болезни — участники должны были сказать, согласны они с ними или нет. «Доктор Питер» выбрал те, с которыми чаще всего соглашались опрошенные. Подтвердить или опровергнуть популярные мифы мы попросили специалиста НМИЦ онкологии им. Петрова.
Рак крови плохо поддается лечению у взрослых (с этим утверждением скорее согласны 61% респондентов)
— Это, скорее, миф. Если рассуждать в общем, то имеет значение возрастной рубеж в 55-60 лет. У пожилых пациентов, действительно, острые лейкозы плохо поддаются лечению. Это связано с тем, что в таком возрасте сложно проводить высокодозную химиотерапию из-за имеющегося у них букета сопутствующих заболеваний. У пациентов моложе 55 острые лейкозы лечатся, как правило, успешнее.
В лечении лейкозов важную роль играет не столько возраст, сколько генетические особенности заболевания. Прежде чем начать лечение, мы обязательно обследуем пациента — выясняем, какой у него вариант лейкоза. От этого зависит всё, включая тактику лечения и прогноз.
Рак крови неизлечим (скорее согласны 31%)
— Это миф. Еще 15-20 лет назад мы могли добиваться какой-то ремиссии и «прощаться» с пациентами. Сейчас лейкоз — болезнь, от которой реально можно вылечиться.
Если рак крови появляется во время беременности, то ребенок родится нездоровым (скорее согласны 26%)
Каких-то конкретных формул нет. Врачи стараются по возможности быстрее разобщить ребенка и маму — неонатологи научились выхаживать 500-граммовых детей, поэтому в последнем триместе выбирается подходящий момент для родов и только потом начинается лечение. Бывает по-другому — первый курс высокодозной терапии проводят во время беременности, потом роды и продолжение лечения женщины. В любом случае развитие лейкоза во время беременности совсем не обязательно говорит о том, что ребенок тоже заболеет лейкозом или родится нездоровым.
Лечение рака крови полностью оплачивается государством (скорее согласны 24%)
— Это правда. Что касается непосредственно лечения пациента — химиотерапии, обследований, лекарств, компонентов крови, операции по пересадке костного мозга — все это действительно полностью оплачивается из федерального бюджета. Под это выделяются так называемые квоты на высокотехнологичную медпомощь.
Сложности возникают на этапе поиска донора костного мозга, при том что пересадка требуется большинству пациентов с острым лейкозом. Если не удается найти донора в российском регистре, который пока не очень многочисленный, приходится обращаться в международные. Так называемую активизацию донора обычно оплачивают благотворительные фонды. В нее входят вызов донора в клинику, типирование, мобилизация (донору вводятся специальные лекарства, которые «выманивают» клетки костного мозга в кровь — в норме их там нет), дорога и проживание, если донор живет в другом городе или даже стране.
Те, кто переболел раком крови, не смогут вести активную жизнь (скорее согласны 20%)
— Это миф. Цель тяжелого и трудоемкого лечения лейкоза — не просто выживание пациента, а достижение хорошего качества жизни. Сейчас все клеточные технологии направлены на то, чтобы человек смог вернуться к полноценной жизни — работе, самореализации, общению. Большинство пациентов, действительно, возвращаются. Помешать может иммунная реакция при неродственной трансплантации костного мозга — так называемая реакция «трансплантат против хозяина» (РТПХ), когда донорские клетки атакуют собственные ткани человека. В таких случаях пациенту дополнительно назначается иммуносупрессивная терапия (для подавления иммунитета), у которой есть свои риски. Когда удается контролировать реакцию с помощью медикаментов, качество жизни пациента не страдает. Если врачи изначально предполагают развитие тяжелой иммунной реакции, от трансплантации отказываются. Тогда используется поддерживающая терапия — для каждого вида лейкоза свои препараты. Новые лекарства появились совсем недавно и большинство из представленных на сегодня в мире уже зарегистрированы в России. С этого года Минздрав выделяет федеральным клиникам квоты на иммунную терапию лейкозов. Наш НМИЦ онкологии тоже участвует в программе. Эта терапия позволяет хорошо контролировать ремиссию и убирать минимальные «остатки» болезни тем пациентам, у которых лейкоз лечат без трансплантации костного мозга.
Опыт ведения беременности у реципиенток солидных органов в условиях многопрофильного стационара
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Трансплантационные технологии позволяют не только восполнять утраченные функции органов, но и дают возможность женщинам реализовать репродуктивную функцию. В мире накоплен большой опыт ведения таких пациенток с положительным перинатальным исходом. В статье представлен опыт ведения беременности и родоразрешения пациенток, перенесших трансплантацию солидных органов. С учетом международного и собственного опыта определены принципы прегравидарной подготовки, ведения беременности и специфической медикаментозной терапии. Показана возможность пролонгирования беременности до доношенного срока при условии мультидисциплинарного подхода к ведению и родоразрешению в специализированном многопрофильном медицинском учреждении, располагающем специалистами с опытом ведения больных, перенесших трансплантацию органов, и владеющими методами оказания высокотехнологичной лечебной и диагностической помощи. До настоящего времени дискутабельными остаются вопросы о проведении иммуносупрессивной терапии, профилактике гестационных осложнений, целесообразных сроках и методах родоразрешения, необходимости индукции родов, а также безопасности грудного вскармливания у женщин с трансплантированными органами.
Ключевые слова: реципиентки солидных органов, трансплантация, прегравидарная подготовка, беременность, родоразрешение, особенности ведения, медикаментозная терапия, влияние на плод.
Для цитирования: Лысенко М.А., Артюхина Л.Ю., Кокая И.Ю. и др. Опыт ведения беременности у реципиенток солидных органов в условиях многопрофильного стационара. РМЖ. Мать и дитя. 2020;3(1):26-30. DOI: 10.32364/2618-8430-2020-3-1-26-30.
The experience with management of pregnancy in women after solid organ transplantation in multidisciplinary hospitals
1 City Clinical Hospital No. 52, Moscow, Russian Federation
2 Pirogov Russian National Research Medical University, Moscow, Russian Federation
Worldwide diffusion of transplantation technologies provides both the recovery of impaired organ functions and the realization of reproductive function. Much experience with the management of these women resulting in the positive perinatal outcome has gained worldwide. However, immunosuppressive therapy, prevention of gestational complications, and the choice of delivery terms and methods are still disputable. This paper summarizes the experience with the management of pregnancy and childbirth in women after solid organ transplantation. The principles of pre-pregnancy planning, the management of pregnancy, and specific medical treatment are addressed considering international and authors’ findings. Potential prolongation of pregnancy until term which requires multidisciplinary approach to the management and delivery and specialized multitype hospital having specialists in the management of patients after transplantation to provide high-tech diagnostic and treatment care is quite possible. Until recently, adequate delivery terms, the need for delivery induction, delivery methods, and the safety of breastfeeding in women after transplantation are still disputable.
Keywords: solid organ recipients, transplantation, pre-pregnancy planning, pregnancy, delivery, management, medical treatment, effects to the fetus.
For citation: Lysenko M.A., Artyukhina L.Yu., Kokaya I.Yu. et al. The experience with management of pregnancy in women after solid organ transplantation in multidisciplinary hospitals. Russian Journal of Woman and Child Health. 2020;3(1):–30. DOI: 10.32364/2618-8430-2020-3-1-26-30.
Введение
Современные трансплантационные технологии являются наиболее прогрессивными методами лечения больных с необратимой стадией хронических заболеваний жизненно важных органов и позволяют добиться оптимальной реабилитации пациентов, в значительной степени повысить уровень выживаемости, качество жизни и вероятность рождения ими здорового потомства. Значительную часть реципиентов трансплантатов солидных органов составляют женщины репродуктивного возраста, восстановление фертильности у которых является важным этапом медицинской и социальной реабилитации. В настоящее время имеются данные о более чем 14 000 родов у женщин с трансплантированными органами [1]. В связи с этим актуальны вопросы прегравидарной подготовки, ведения беременности и родов у таких пациенток.
Благоприятный исход беременности после трансплантации солидных органов наблюдается у 65–92% пациенток. Однако, учитывая коморбидный фон и необходимость перманентной иммуносупрессии, риски неблагоприятных акушерских событий, в т. ч. развития преэклампсии, задержки роста плода и преждевременных родов, значительно выше, чем в общей популяции [2].
Иммуносупрессивная терапия. Поддерживающая перманентная иммуносупрессивная терапия необходима для обеспечения максимальной функциональной способности трансплантата, что определяется адекватностью подавления аллоиммунного ответа, с одной стороны, и минимизацией риска побочных эффектов иммунодепрессантов — с другой. Оптимальный режим иммуносупрессивной терапии обеспечивается применением лекарственного мониторинга, позволяющего поддерживать терапевтический диапазон концентрации препарата. Наиболее распространенными иммуносупрессивными препаратами, применяемыми при беременности, являются производные циклоспорина и такролимуса (ингибитор кальциневрина по сравнению с циклоспорином характеризуется более лабильной фармакокинетикой).
Грудное вскармливание у реципиенток трансплантированных органов. Возможность безопасного грудного вскармливания у реципиенток недостаточно изучена и не рекомендуется пациенткам, принимающим иммуносупрессивные препараты, в т. ч. сиролимус, эверолимус и белатацепт. Однако за последние 25 лет в мире описано большое количество случаев грудного вскармливания у таких пациенток. В 2014 г. опубликованы данные о безопасности грудного вскармливания и быстром снижении концентрации иммуносупрессантов в крови новорожденных у реципиенток трансплантатов, получавших стандартные дозы преднизолона, азатиоприна, циклоспорина и такролимуса [3]. С одной стороны, любой иммуносупрессант потенциально небезопасен для новорожденного, с другой — установленные относительно небольшие количества препарата, передающиеся ребенку с грудным молоком, и малая частота побочных эффектов, о которых сообщают единичные публикации, указывают на то, что благоприятный эффект грудного вскармливания может превышать теоретические риски негативного влияния иммуносупрессантов [4].
Трансплантация почки и беременность
В литературе описано несколько тысяч беременностей у женщин с почечным трансплантатом, из которых около 90% завершились благополучно, в т. ч. при трансплантации почек реципиенткам с волчаночным нефритом. Однако полиморфизм патологических состояний трансплантата почки диктует необходимость тщательного контроля течения беременности, динамического мониторинга клинико-лабораторных показателей, проведения дифференциальной диагностики гестационных осложнений и, при необходимости, своевременной активной этиотропной или патогенетической терапии. Заболевания почек являются отягчающим фоном, однако прогноз в большей степени определяется патологией, непосредственно ассоциированной с беременностью, такой как преэклампсия, эклампсия, HELLP-синдром. Наиболее частыми коморбидными состояниями пациенток с почечным трансплантатом являются артериальная гипертензия, снижение скорости клубочковой фильтрации и почечная недостаточность, что нередко затрудняет своевременную диагностику тяжелых гестационных осложнений, в т. ч. преэклампсии [2, 5–7].
Клиническое наблюдение. Пациентка С., 31 год.
Данные анамнеза. С 2000 г. по поводу манифестации геморрагического васкулита с поражением кожи и почек проводилась патогенетическая терапия кортикостероидами (преднизолон 60 мг per os). В 2009 г. в связи с терминальной стадией хронической почечной недостаточности (ХПН) начато лечение программным гемодиализом (ПГД). В 2010 г. произведена трансплантация почки (ТП) матери. В 2013 г. после перенесенной ОРВИ и обострения хронического гломерулонефрита (морфологически — IgA-нефропатия) с быстрым прогрессированием ХПН начато лечение ПГД. Трансплантатэктомия не проводилась. В 2014 г. произведена повторная ТП. В 2015 г. в связи с развитием мочевого синдрома гломерулонефрита трансплантата (морфологически — IgA-нефропатия) проведена патогенетическая пульс-терапия преднизолоном (метипред 1500 мг) с положительным эффектом. В 2017 г. в связи с планированием беременности отменены ингибиторы ангиотензинпревращающего фермента и микофенолата мофетил. Начата иммуносупрессивная терапия азатиоприном.
В 2017 г. диагностирована беременность.
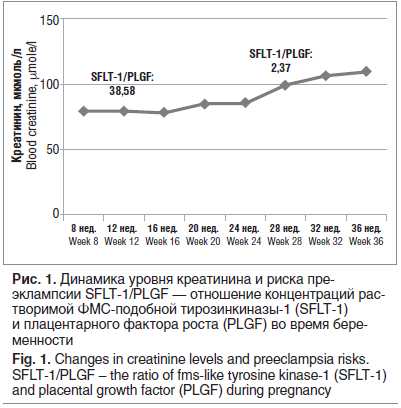
Течение беременности и родов. На учете в женской консультации — с 10–11-й нед. беременности. Ведение беременности осуществлялось совместно акушером-гинекологом и нефрологом с проведением мониторинга азотемических показателей, концентрации такролимуса в крови (рис. 1, 2), определения уровня маркеров преэклампсии (плацентарного фактора роста — PLGF, растворимой ФМС-подобной тирозинкиназы — SFLT).
Пациентка родоразрешена на 38–39-й нед. беременности в плановом порядке путем кесарева сечения совместной бригадой врачей акушеров и урологов. Родился доношенный мальчик весом 2730 г, рост 49 см, оценка по шкале Апгар 7–9 баллов. Находится на искусственном вскармливании. При обследовании родильницы в течение последующих месяцев дисфункция трансплантата не выявлена.
Трансплантация печени и беременность
Беременные с трансплантированной печенью, как правило, высокотолерантны к гестационным осложнениям, в первую очередь к развитию преэклампсии, и имеют более благоприятный перинатальный исход по сравнению с реципиентками почки. Иммуносупрессивный фон у данных пациенток более благоприятный, т. к. терапия обычно включает только один лекарственный препарат, что уменьшает риск инфекционных осложнений. К группе высокого потенциального риска дисфункции трансплантированной печени и неблагоприятного перинатального исхода следует отнести беременных, у которых трансплантация проведена в связи с вирусным гепатитом В.
Беременность на фоне наличия печеночного трансплантата может сопровождаться тромбоцитопенией, умеренным повышением уровней печеночных трансаминаз, билирубина, снижением альбумина. Наиболее частое осложнение у реципиенток с трансплантированной печенью по сравнению с реципиентами других органов — холестаз беременных [8–10].
В ГБУЗ «ГКБ № 52 ДЗМ» за 2018–2019 гг. родоразрешены 2 пациентки с трансплантатами печени. Течение беременности и родов прошло без осложнений.
Клиническое наблюдение. Пациентка Л., 37 лет.
Данные анамнеза. В 1990 г. впервые манифестировала желтуха неинфекционной этиологии, разрешившаяся на фоне инфузионной и гормональной терапии в течение 1 мес. С 1991 г. впервые манифестировал инсулинозависимый сахарный диабет. В 1995 г. выставлен диагноз: цирроз печени в исходе аутоиммунного тиреоидита. Портальная гипертензия III степени. Гепатоспленомегалия. Гиперспленизм. Тромбоцитопения. Сахарный диабет 1 типа. Медикаментозный синдром Иценко — Кушинга (длительный прием глюкокортикостероидов). Остеопения. В 2013 г. выполнена ортотопическая трансплантация печени с сохранением ретропеченочного отдела нижней полой вены.
Первая беременность в 2003 г. закончилась абортом по медицинским показаниям в сроке 7–8 нед. Вторая беременность в 2006 г. закончилась преждевременными родами в сроке 34 нед. путем кесарева сечения по поводу тяжелой преэклампсии. Родилась живая недоношенная девочка весом 2000 г, рост 45 см. Постнатальный исход благоприятный. В 2003–2007 гг. дважды проводилось лигирование вен пищевода по поводу кровотечения. Третья беременность — желанная, наступила сразу после отмены барьерной контрацепции.
Течение беременности и родов. Ведение беременности осуществлялось акушером-гинекологом совместно с гепатологом ФГБУ «НЦАГиП им. В.И. Кулакова» и эндокринологом ГБУЗ «ГКБ № 52 ДЗМ» на фоне тщательного динамического наблюдения, постоянного контроля клинико-лабораторных параметров. Беременная принимала такролимус 7 мг/сут под контролем концентрации препарата в крови (контроль осуществлялся в МГНЦ ГБУЗ «ГКБ № 52 ДЗМ») и получала инсулинотерапию по базовому профилю.
Беременность протекала без осложнений. В сроке 37 нед. произведено плановое кесарево сечение. Родился живой доношенный мальчик весом 3160 г, рост 50 см. На 7-е сут мама и ребенок выписаны домой в удовлетворительном состоянии.
Трансплантация легких и беременность
Трансплантация легких является признанным методом лечения терминальных стадий болезней легких с исчерпанным медикаментозным ресурсом лечения, в т. ч. с идиопатической легочной гипертензией (ИЛГ).
ИЛГ (болезнь Аэрза, синдром Эскудеро, черный цианоз) — это заболевание неизвестной этиологии, характеризующееся выраженным повышением общего легочного сосудистого сопротивления и давления в легочной артерии, прогрессирующим течением и быстрым развитием правожелудочковой недостаточности с неблагоприятным прогнозом выживаемости. По данным ВОЗ, ИЛГ относится к одним из самых редких заболеваний сердечно-сосудистой системы в мире с популяционной частотой не более 1–2 случаев на 1 млн населения в год и занимает 7-е место в списке показаний к трансплантации легких. ИЛГ может возникнуть в любом возрасте независимо от пола. Наиболее часто дебют заболевания у женщин отмечается в 20–30 лет, а причиной смерти в 47% случаев является правожелудочковая сердечная недостаточность и у 26% больных — внезапная остановка сердца.
В 1996–2016 гг. частота операций по трансплантации легких в мире выросла с 1297 до 4661 в год. Беременность после трансплантации является актуальной проблемой, т. к. треть реципиентов легких составляют женщины, 75% из которых находятся в репродуктивном возрасте. Возможность проведения трансплантации легких позволила увеличить выживаемость пациенток, качество жизни и вероятность успешной беременности. В мире за 1991–2017 гг. успешно проведено 44 беременности, в т. ч. многоплодные, от которых родились 46 детей [11, 12].
Беременность после трансплантации легких сопровождается высоким риском материнской и перинатальной заболеваемости и смертности и требует мультидисциплинарного подхода к ведению и родоразрешению. Частота случаев отторжения трансплантата легких у беременных составляет 16–36%, что достоверно выше по сравнению с частотой отторжения трансплантатов других органов, в т. ч. сердца (9–20%), печени (4,5–10%) и почек (1–9%). В структуре осложнений беременности у реципиенток с трансплантатом легких частота самопроизвольного выкидыша составляет 28%, гестационной артериальной гипертензии — 53,3%, преждевременных родов — более 50% (средний срок 33,9 нед.). При этом риск материнской смертности превышает 16% [1].
Клиническое наблюдение. Пациентка К., 27 лет.
Данные анамнеза. В 2013 г. через год после первых родов диагностирована ИЛГ. Консервативная терапия (силденафил) — без эффекта. В 2015 г. выполнена трансплантация легких. Послеоперационный период осложнился тяжелой первичной дисфункцией трансплантатов, острой почечной недостаточностью и формированием гемоторакса справа, что потребовало проведения реторакотомии, санации плевральной полости и гемодиализа. Назначена пожизненная иммуносупрессивная терапия.
Первая беременность — в 2010 г., неразвивающаяся, в 6–7 нед. произведен медикаментозный аборт без осложнений. Вторая беременность в 2013 г. закончилась своевременно рождением мальчика весом 3400 г, рост 52 см, без осложнений. Третья беременность в 2017 г. прервана по медицинским показаниям до 12 нед. (в связи с приемом иммуносупрессанта сертикана, обладающего тератогенным эффектом).
В 2018 г. наступила запланированная беременность.
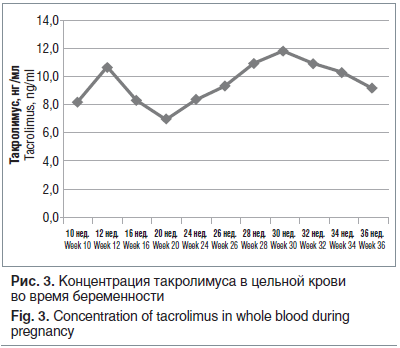
Течение беременности и родов. На учете в женской консультации при ГКБ № 52 — с 7–8-й нед. беременности. Ведение беременности осуществлялось совместно акушером-гинекологом, трансплантологом, нефрологом, терапевтом. Беременность осложнилась угрожающим выкидышем в I триместре, анемией легкой степени. Проводилось лечение угрожающего выкидыша производными прегнена, антианемическая и комбинированная иммуносупрессивная терапия: кортикостероиды (метилпреднизолон 4 мг/сут), ингибитор кальциневрина (такролимус 4 мг/сут). Иммуносупрессия корригировалась на основании оценки концентрации такролимуса в крови (рис. 3). Целевой уровень концентрации такролимуса — 8–10 нг/мл.
В 32–33 нед. гестации перенесла ОРВИ и левосторонний отит с последующим развитием одышки при незначительной физической нагрузке.
Результаты динамической оценки функции внешнего дыхания: снижение объема форсированного выдоха в I триместре беременности с прогрессирующим снижением на 3,4% от стартового уровня в 38 нед. беременности.
Результаты трансторакальной эхо-кардиографии: нарушений функции миокарда, признаков легочной гипертензии не выявлено.
В 37–38 нед. беременности, учитывая доношенный срок беременности, удовлетворительное состояние трансплантата, консилиум в составе врачей акушеров-гинекологов, трансплантологов, анестезиологов-реаниматологов, неонатологов принял решение о проведении операции кесарева сечения. Метод обезболивания — спинально-эпидуральная анестезия. Извлечена доношенная девочка весом 2590 г, рост 48 см, оценка по шкале Апгар 8–9 баллов. Ранний неонатальный период протекал удовлетворительно, с искусственным вскармливанием. Уровень такролимуса в крови у ребенка в раннем неонатальном периоде более чем 3-кратно снизился в течение первых 5 сут жизни (рис. 4).
В связи с высоким риском отторжения трансплантата родильнице в послеродовом периоде проведена индивидуальная коррекция иммуносупрессанта (такролимуса). Выписана домой с ребенком в удовлетворительном состоянии на 7-е сут после родоразрешения.
Заключение
Международный и собственный опыт ведения беременности у женщин с трансплантированными органами позволяет утверждать, что благополучное завершение беременности возможно при тщательном контроле функции трансплантата, состояния беременной реципиентки солидного органа и плода на протяжении всего периода гестации. Одним из важнейших критериев успешной беременности и благоприятного перинатального исхода у женщин с трансплантированным солидным органом следует считать интервал после трансплантации не менее 1 года, в течение которого, как правило, достигается оптимальный уровень иммуносупрессии, обеспечивающий стабильную функцию трансплантата, отсутствие или малую выраженность дисфункции других органов и минимальный риск инфекционных осложнений. Пациентам после трансплантации нередко проводится 2–3-компонентная иммуносупрессивная терапия. В связи с этим при планировании беременности необходима минимизация иммуносупрессоров и отмена тератогенных препаратов. При ведении беременности необходимы динамический контроль и своевременная коррекция дозы иммуносупрессоров. Концентрацию в крови ингибиторов кальциневрина (циклоспорина, такролимуса) снижают с увеличением срока гестации и с целью профилактики развития дисфункции или отторжения трансплантата. Во время беременности рекомендуется перманентная коррекция дозы в соответствии с концентрацией иммуносупрессивного препарата в крови.
На основании вышесказанного можно сделать следующие выводы.
После трансплантации необходима контрацепция с последующим планированием беременности.
Ключевым компонентом в подготовке к беременности является стабильная функция трансплантата в течение 1 года — 2 лет.
Беременность у реципиенток трансплантатов находится в зоне высокого риска, что требует междисциплинарного подхода к ведению и родоразрешению в специализированном многопрофильном медицинском учреждении, имеющем специалистов с опытом ведения больных после трансплантации и владеющих методами оказания высокотехнологичной лечебной и диагностической помощи.
Беременность пациенткам с аллотрансплантатом почки не противопоказана при соблюдении следующих условий: 1) отсутствие или минимальная протеинурия; 2) управляемая артериальная гипертензия; 3) отсутствие нарушений уродинамики трансплантата; 4) нормальная скорость клубочковой фильтрации (креатинин крови 1 Лысенко Марьяна Анатольевна — д.м.н., главный врач, ORCID iD 0000-0002-2636-2558;
1 Артюхина Людмила Юрьевна — к.м.н., заведующая нефрологическим отделением № 1, ORCID iD 0000-0003-3353-1636;
1 Кокая Инга Юрьевна — к.м.н., заведующая родильным домом, ORCID iD 0000-0002-0637-1537;
2 Козлов Павел Васильевич — д.м.н., профессор кафедры акушерства и гинекологии лечебного факультета, ORCID iD 0002-9916-6128;
1 Осокин Иван Павлович — заведующий отделением патологии беременности, ORCID iD 0000-0003-2957-7236.
1 ГБУЗ «ГКБ № 52 ДЗМ». 123182, Россия, г. Москва, ул. Пехотная, д. 3.
2 ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России. 117997, Россия, г. Москва, ул. Островитянова, д. 1.
Контактная информация: Козлов Павел Васильевич, e-mail: drkpv@mail.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 25.10.2019.
1 Mariana A. Lysenko — MD, PhD, the Head Doctor, ORCID iD 0000-0002-2636-2558;
1 Ludmila Yu. Artyukhina — MD, PhD, Head of the Department of Nephrology, ORCID iD 0000-0003-3353-1636;
1 Inga Yu. Kokaya — MD, PhD, Head of the Maternity Hospital, ORCID iD 0000-0002-0637-1537;
2 Pavel V. Kozlov — MD, PhD, Professor of the Department of Obstetrics and Gynecology, ORCID iD 0000-0002-9916-6128;
1 Ivan P. Osokin — MD, Head of the Department of Pathological Pregnancy, ORCID iD 0000-0003-2957-7236.
1 City Clinical Hospital No. 52. 3, Pehotnaja str., Moscow, 123182, Russian Federation.
2 Pirogov Russian National Research Medical University. 1, Ostrovitianov str., Moscow, 117997, Russian Federation.
Contact information: Pavel V. Kozlov, e-mail: drkpv@mail.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 25.10.2019.
Только для зарегистрированных пользователей