что является сигналом индуцирующим синтез эритроцитов в костном мозге
Что является сигналом индуцирующим синтез эритроцитов в костном мозге
Стадии дифференцировки красных клеток крови. Первой клеткой, которую можно идентифицировать как принадлежащую к группе красных клеток крови, является проэритробласт, показанный как отправная точка на рисунке ниже.
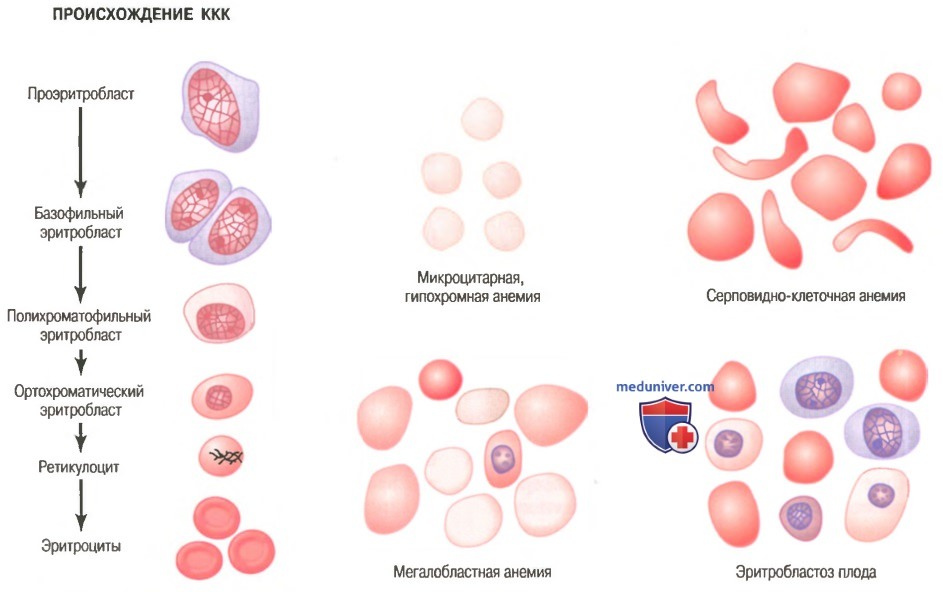
При соответствующей стимуляции большие количества этих клеток формируются из стволовых клеток КОЕ-Э.
Сразу после образования проэритробласт делится много раз, в результате формируются много зрелых красных клеток крови. Клетки первой генерации называют базофилъными эритробластами, поскольку они окрашиваются основными красителями; к этому времени клетка накапливает очень мало гемоглобина.
В последующих генерациях, как показано на рисунке, клетки наполняются гемоглобином до концентрации, равной примерно 34%, ядро сжимается до небольшого размера, и его конечный остаток абсорбируется или выдавливается из клетки. В то же время абсорбируется эндоплазматический ретикулум. На этом этапе клетку называют ретикулоцитому поскольку она все еще содержит небольшое количество базофильного материала, состоящего из остатков аппарата Гольджи, митохондрий и некоторых других цитоплазматических органелл.
Во время этой ретикулоцитарной стадии клетки выходят из костного мозга в кровеносные капилляры путем диапедеза (просачиваясь сквозь поры капиллярной мембраны).
Остаточный базофильный материал ретикулоцита в норме исчезает в течение 1-2 сут, и после этого клетка становится зрелым эритроцитом. В связи с короткой жизнью ретикулоцитов их концентрация среди всех клеток крови обычно немного ниже 1%.
Регуляция продукции красных клеток крови. Роль эритропоэтина
Общая масса эритроцитов в системе кровообращения регулируется в узких пределах, поэтому, с одной стороны, (1) всегда имеется адекватное количество красных клеток крови для обеспечения достаточного транспорта кислорода из легких к тканям, с другой стороны, (2) клеток не становится так много, чтобы они мешали кровотоку. Известные в настоящее время данные об этом контроле представлены в виде схемы на рисунке ниже и заключаются в следующем.
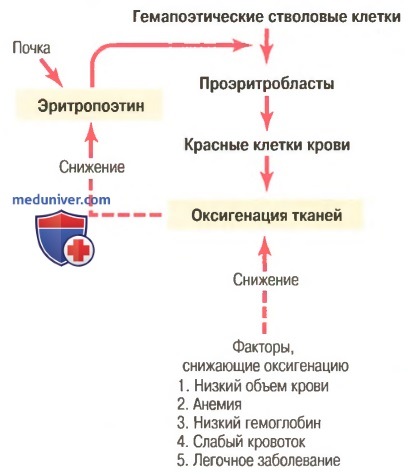
а) Оксигенация тканей является наиболее важным регулятором продукции красных клеток крови. Любое состояние, ведущее к уменьшению доставки кислорода тканям, обычно увеличивает скорость образования эритроцитов. Следовательно, если в результате кровотечения или любого другого состояния у человека развивается анемия, костный мозг немедленно усиливает продукцию красных клеток крови. Кроме того, разрушение значительной части костного мозга по любой причине, особенно при рентгенотерапии, ведет к гиперплазии оставшегося костного мозга, что отражает попытку удовлетворить потребности организма в эритроцитах.
На очень больших высотах, где количество кислорода в воздухе сильно снижено, снабжение тканей кислородом становится недостаточным, и продукция красных клеток крови резко возрастает. В этом случае образование эритроцитов регулирует не их концентрация в крови, а несоответствие между доставкой кислорода тканям и потребностями тканей в кислороде.
Скорость продукции красных клеток крови возрастает также при различных болезнях системы кровообращения, сопровождаемых снижением кровотока через периферические сосуды, особенно на фоне недостаточности поглощения кислорода при прохождении крови через легкие. Так, тканевая гипоксия, характерная для хронической сердечной недостаточности и многих легочных заболеваний, стимулирует продукцию красных клеток крови, что ведет к увеличению гематокрита и, как правило, общего объема крови.
б) Эритропоэтин стимулирует продукцию красных клеток крови, а его образование возрастает в ответ на гипоксию. Главным стимулом для продукции эритроцитов при состояниях с низким содержанием кислорода является циркулирующий в крови гормон эритропоэтин — гликопротеин с молекулярной массой около 34000. При отсутствии эритропоэтина гипоксия практически не стимулирует продукцию эритроцитов. Но когда система эритропоэтина функционирует, гипоксия вызывает заметное увеличение секреции эритропоэтина, а он, в свою очередь, усиливает образование красных клеток крови до тех пор, пока гипоксия не исчезнет.
в) Роль почек в формировании эритропоэтина. У здорового человека примерно 90% всего эритропоэтина синтезируется в почках; остальная часть образуется в основном в печени. Пока точно не известно, где именно в почках синтезируется эритропоэтин. Одним из возможных мест секреции эритропоэтина являются эпителиальные клетки почечных канальцев, поскольку анемичная кровь околоканальцевых капилляров не способна удовлетворить их высокую потребность в кислороде, что стимулирует продукцию эритропоэтина.
Иногда секрецию эритропоэтина почками стимулирует гипоксия не в почках, а в других частях тела, что позволяет предположить возможное существование некоего внепочечного сенсора, который посылает к почкам дополнительный сигнал, стимулирующий продукцию этого гормона. В частности, норадреналин, адреналин и некоторые из простагландинов стимулируют продукцию эритропоэтина.
Когда у человека удаляют обе почки или если они разрушены болезнью, у человека неминуемо развивается тяжелая анемия, поскольку эритропоэтин, синтезируемый другими тканями (в основном печенью), составляет лишь 10% нормы и может обеспечить формирование не более половины красных клеток крови, необходимых организму.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
— Вернуться в оглавление раздела «Физиология человека.»
Гематологические исследования
Гемопоэз
1. Гемопоэз: понятие, локализация.
Гемопоэз — процесс образования форменных элементов крови: эритроцитов (эритропоэз), лейкоцитов (лейкопоэз) и тромбоцитов (тромбоцитопоэз).
Он совершается в красном костном мозге, где образуются эритроциты, все зернистые лейкоциты, моноциты, тромбоциты, В-лимфоциты и предшественники Т-лимфоцитов. В тимусе проходит дифференцировка Т-лимфоцитов, в селезенке и лимфатических узлах — дифференцировка В-лимфоцитов и размножение Т-лимфоцитов.
Общей родоначальной клеткой всех клеток крови является полипотентная стволовая клетка крови, которая способна к дифференцировке и может дать начало роста любым форменным элементам крови и способна к длительному самоподдержанию. Каждая стволовая кроветворная клетка при своем делении превращается в две дочерние клетки, одна из которых включается в процесс пролиферации, а вторая идет на продолжение класса полипотентных клеток. Дифференцировка стволовой кроветворной клетки происходит под влиянием гуморальных факторов. В результате развития и дифференцировки разные клетки приобретают морфологические и функциональные особенности.
Полипотентные стволовые гемопоэтические клетки находятся в красном костном мозге и способны к самообновлению. Они могут также циркулировать в крови вне органов кроветворения. ПСГК костного мозга при обычной дифференциации дают начало всем типам зрелых клеток крови — эритроцитам, тромбоцитам, базофилам, эозинофилам, нейтрофилам, моноцитам, В- и Т-лимфоцитам. Для поддержания клеточного состава крови на должном уровне в организме человека ежесуточно образуется в среднем 2,00 • 10 11 эритроцитов, 0,45 • 10 11 нейтрофилов, 0,01 • 10 11 моноцитов, 1,75 • 10 11 тромбоцитов. У здоровых людей эти показатели достаточно стабильны, хотя в условиях повышенной потребности (адаптация к высокогорью, острая кровопотеря, инфекция) процессы созревания костномозговых предшественников ускоряются. Высокая пролиферативная активность стволовых гемопоэтических клеток перекрывается физиологической гибелью (апоптозом) их избыточного потомства (в костном мозге, селезенке или других органах), а в случае необходимости и их самих.
Подсчитано, что каждый день в организме человека теряется (2-5) • 10 11 клеток крови, которые замешаются на равное количество новых. Чтобы удовлетворить эту огромную постоянную потребность организма в новых клетках, гемоцитопоэз не прерывается в течение всей жизни. В среднем у человека за 70 лет жизни (при массе тела 70 кг) образуется: эритроцитов — 460 кг, гранулоцитов и моноцитов — 5400 кг, тромбоцитов — 40 кг, лимфоцитов — 275 кг. Поэтому кроветворные ткани рассматриваются как одни из наиболее митотически активных.
Современные представления о гемоцитопоэзе базируются на теории стволовой клетки, основы которой были заложены русским гематологом А.А. Максимовым в начале XX в. Согласно данной теории, все форменные элементы крови происходят из единой (первичной) полипотентной стволовой гемопоэтической (кроветворной) клетки (ПСГК). Эти клетки способны к длительному самообновлению и в результате дифференциации могут дать начало любому ростку форменных элементов крови и одновременно сохранять их жизнеспособность и свойства.
Стволовые клетки (СК) являются уникальными клетками, способными к самообновлению и дифференцировке не только в клетки крови, но и в клетки других тканей. По происхождению и источнику образования и выделения СК разделяют на три группы: эмбриональные (СК эмбриона и тканей плода); региональные, или соматические (СК взрослого организма); индуцированные (СК, полученные в результате репрограммирования зрелых соматических клеток). По способности к дифференцировке выделяют тоти-, плюри-, мульти- и унипотентные СК. Тотипотентная СК (зигота) воспроизводит все органы эмбриона и структуры, необходимые для его развития (плаценту и пуповину). Плюрипотентная СК может быть источником клеток, производных любого из трех зародышевых листков. Мульти (поли) потентная СК способна образовывать специализированные клетки нескольких типов (например клетки крови, клетки печени). Унипотентная СК в обычных условиях дифференцируется в специализированные клетки определенного типа. Эмбриональные СК являются плюрипотентными, а региональные — полипотентными или унипотентными. Частота встречаемости ПСГК составляет в среднем 1:10 000 клеток в красном костном мозге и 1:100 000 клеток в периферической крови. Плюрипотентные СК могут быть получены в результате репрограммирования соматических клеток различного типа: фибробластов, кератиноцитов, меланоцитов, лейкоцитов, β-клеток поджелудочной железы и другие, с участием факторов транскрипции генов или микроРНК.
Все СК обладают рядом общих свойств. Во-первых, они недифференцированы и не располагают структурными компонентами для выполнения специализированных функций. Во- вторых, они способны к пролиферации с образованием большого числа (десятков и сотен тысяч) клеток. В-третьих, они способны к дифференцировке, т.е. процессу специализации и образованию зрелых клеток (например, эритроцитов, лейкоцитов и тромбоцитов). В-четвертых, они способны к асимметричному делению, когда из каждой СК образуются две дочерние, одна из которых идентична родительской и остается стволовой (свойство самообновления СК), а другая дифференцируется в специализированные клетки. Наконец, в-пятых, СК могут мигрировать в очаги повреждения и дифференцироваться в зрелые формы поврежденных клеток, способствуя регенерации тканей.
Различают два периода гемоцитопоэза: эмбриональный — у эмбриона и плода и постнатальный — с момента рождения и до конца жизни. Эмбриональное кроветворение начинается в желточном мешке, затем вне его в прекардиальной мезенхиме, с 6-недельного возраста оно перемещается в печень, а с 12 — 18-недельного возраста — в селезенку и красный костный мозг. С 10-недельного возраста начинается образование Т-лимфоцитов в тимусе. С момента рождения главным органом гемоцитопоэза постепенно становится красный костный мозг. Очаги кроветворения имеются у взрослого человека в 206 костях скелета (грудине, ребрах, позвонках, эпифизах трубчатых костей и др.). В красном костном мозге происходит самообновление ПСГК и образование из них миелоидной стволовой клетки, называемой также колониеобразующей единицей гранулоцитов, эритроцитов, моноцитов, мегакариоцитов (КОЕ-ГЭММ); лимфоидную стволовую клетку. Мислоидная полиолигопотентная стволовая клетка (КОЕ-ГЭММ) может дифференцироваться: в монопотентные коммитированные клетки — предшественницы эритроцитов, называемые также бурстобразующей единицей (БОЕ-Э), мегакариоцитов (КОЕ- Мгкц); в полиолигопотентные коммитированные клетки гранулоцитов-моноцитов (КОЕ-ГМ), дифференцирующиеся в монопотентные предшественницы гранулоцитов (базофилы, нейтрофилы, эозинофилы) (КОЕ-Г), и предшественницы моноцитов (КОЕ-М). Лимфоидная стволовая клетка является предшественницей Т- и В- лимфоцитов.
В красном костном мозге из перечисленных колониеобразующих клеток через ряд промежуточных стадий образуются регикулоциты (предшественники эритроцитов), мегакариоциты (от которых «отшнуровываются» тромбоцит!,i), гранулоциты (нейтрофилы, эозинофилы, базофилы), моноциты и В-лимфоциты. В тимусе, селезенке, лимфатических узлах и лимфоидной ткани, ассоциированной с кишечником (миндалины, аденоиды, пейеровы бляшки) происходит образование и дифференцирование Т-лимфоцитов и плазматических клеток из В-лимфоцитов. В селезенке также идут процессы захвата и разрушения клеток крови (прежде всего эритроцитов и тромбоцитов) и их фрагментов.
В красном костном мозге человека гемоцитопоэз может происходить только в условиях нормального гемоцитопоэзиндуцирующего микроокружения (ГИМ). В формировании ГИМ принимают участие различные клеточные элементы, входящие в состав стромы и паренхимы костного мозга. ГИМ формируют Т-лимфоциты, макрофаги, фибробласты, адипоциты, эндотелиоциты сосудов микроциркуляторного русла, компоненты экстрацеллюлярного матрикса и нервные волокна. Элементы ГИМ осуществляют контроль за процессами кроветворения как с помощью продуцируемых ими цитокинов, факторов роста, так и благодаря непосредственным контактам с гемопоэтическими клетками. Структуры ГИМ фиксируют стволовые клетки и другие клетки-предшественницы в определенных участках кроветворной ткани, передают им регуляторные сигналы, участвуют в их метаболическом обеспечении.
Гемоцитопоэз контролируется сложными механизмами, которые могут поддерживать его относительно постоянным, ускорять или тормозить, угнетая пролиферацию и дифферен- цировку клеток вплоть до инициирования апоптоза коммитированных клеток-предшественниц и даже отдельных ПСГК.
11.3. Регуляция эритропоэза
Образование форменных элементов крови (гемопитопоэз) осуществляется в специализированных гемопоэтических тканях: миело-идной (в эпифизах трубчатых и полости многих губчатых костей) и лимфоидной (тимус, селезенка, лимфатические узлы). В миелоид-ной ткани образуются эритроциты, грануло-питы, моноциты, тромбоциты, предшественники лимфоцитов. В лимфоидной ткани происходят образование лимфоцитов, плазматических клеток, а также процессы элиминации клеток крови и продуктов их распада. Эритропоэз — это процесс образования эритроцитов в организме, который связан с эритроном. Эритрон — система красной крови, включающая периферическую кровь, органы эритропоэза и эритроциторазрушения. Основные клетки эритрона: 1) ядросодержа-щие эритроидные клетки костного мозга — эритрокариоциты; 2) ретикулоциты костного мозга; 3) ретикулоциты крови; 4) зрелые эритроциты периферической крови. В костном мозге находится лишь 6 % клеток эритрона, в циркулирующей крови — 94 %.
Поддержание постоянного количества эритроцитов в периферической крови, имеющих продолжительность жизни около 120 дней, возможно лишь при достаточной скорости эритропоэза. Популяция циркулирующих эритроцитов в норме составляет около 25×10 клеток, содержащих 750 г гемоглобина. Для поддержания постоянства содержания эритроцитов в периферической крови в костном мозге здорового человека массой 70 кг ежесуточно образуется примерно (20— 25)х1О |С эритроцитов, а из костного мозга в кровь освобождается в 1 мин примерно 1,8х10 9 молодых эритроцитов (ретикулоци-тов). В условиях патологии, при чрезвычайной стимуляции гемопоэза (гипоксия, гемолиз, кровопотеря), интенсивность эритропоэза может возрастать в 6—8 раз (схема 11.2).
Важнейшим регулятором эритропоэза является эритропоэтин. По физико-химическим свойствам эритропоэтин относится к
группе кислых гликопротеидов. Биологическая активность эритропоэтина в значительной мере обусловлена наличием в молекуле остатков тирозина, триптофана, а также сиа-ловой кислоты. Человеческий эритропоэтин представляет собой димер с молекулярной массой от 46 000 до 50 000-60 000 Д. Установлен химический состав высокоочищен-ных препаратов почечного эритропоэтина: содержание белка в нем составляет около 65,5 %, углеводов — около 30 %.
Считают, что основным органом синтеза эритропоэтина являются почки. Местом образования почечного эритропоэтина является юкстагломерулярный аппарат (ЮГА) почек. Есть работы, доказывающие каналь-цевое происхождение эритропоэтина. В небольших концентрациях он вырабатывается печенью и слюнными железами. Эритропоэтин обнаруживается в плазме крови здоровых людей. Выделяется эритропоэтин с мочой, а также в составе слюны и желудочного сока.
Останавливаясь на молекулярных механизмах действия эритропоэтина, необходимо отметить, что для него характерен мембранный тип рецепции эритропоэтинчувствитель-ными клетками. Вторичным сигналом, который возникает при взаимодействии эритропоэтина с рецепторами клеточной мембраны и действует на ядро, является изменение внутриклеточных концентраций циклических нуклеотидов, ионов калия и кальция.
Основным фактором, стимулирующим образование эритропоэтина, является гипоксия различного происхождения (при сердечной, легочной недостаточности, кровопотерях, гемолизе эритроцитов, снижении барометрического давления). Можно выделить не-
сколько механизмов стимуляции образования эритропоэтина в условиях гипоксии.
Прямое воздействие крови с пониженным парциальным напряжением О2 на клетки ЮГА и канальцевый аппарат, продуци рующие эритропоэтин.
Опосредованный эффект через активацию гипоталамо-гипофизарно-надпочечнико вой системы в условиях гипоксии, усиле ние выброса гормонов адаптации — глю- кокортикоидов, катехоламинов, стимули рующих гуморальным путем образование эритропоэтина в почках и усиление про цессов эритропоэза в костном мозге.
Изменение снабжения организма кислородом в ту или иную сторону от нормального включает гуморальные механизмы регуляции эритропоэза, направленные на восстановление этого параметра. При недостатке кислорода вырабатывается эритропоэтин, стимулирующий эритропоэз, а при избытке — ингибитор эритропоэза, снижающий уровень последнего. У взрослого человека в более широком диапазоне проявляются эритро-поэзстимулирующие реакции, в раннем возрасте — эритропоэзтормозящие.
Синтез эритропоэтина контролируется рефлекторным механизмом: хеморецепторы каротидного синуса — гипоталамус — спинной мозг — симпатические нервы почек. У животных с выключением любого отдела рефлекторной дуги стимуляция эритропоэза при гипоксии сохраняется, но запаздывает в развитии. Таким образом, эта стимуляция имеет сложный нервно-гуморальный механизм, где центральное место занимает эритропоэтин, скорость включения которого обеспечивает нервная система.
Важнейшими модуляторами эритропоэза являются гормоны. Тропные гормоны адено-гипофиза (АКТГ, ТТГ, ГТГ) оказывают стимулирующее воздействие на эритропоэз за счет усиления продукции соответствующих гормонов периферическими эндокринными железами — глюкокортикоидов, тироксина, трийодтиронина, андрогенов. Стимулирующим воздействием на эритропоэз обладает и соматотропин. Очевидно, что главным механизмом действия гипофизарных гормонов на эритропоэз является модуляция продукции и секреции эритропоэтина в почках. Стимуляция эритропоэза после введения гипофизарных гормонов и гормонов периферических желез может быть связана с повышением утилизации О2 в тканях и возникновением его дефицита в почках. Стимулирующим воздействием на эритропоэз обладают гипофи-
зарный и плацентарный пролактин, обеспечивая активацию эритропоэза во время беременности.
Тиреоидные гормоны оказывают стимулирующее воздействие на эритропоэз не только путем повышения почечной продукции эритропоэтина, но и путем прямого действия на эритропоэтинчувствительные клетки, реализуемого через р^-ЗДренореЦепторы. В отличие от андрогенов эстрогены оказывают тормозящее влияние на эритропоэз. В последние годы появились работы, свидетельствующие о возможном участии гормонов поджелудочной железы в регуляции эритропоэза. Установлено, что инсулин в больших фармакологических концентрациях стимулирует образование эритропоэтина. В противоположность действию инсулина глюкагон оказывает ингибирующее влияние на эритропоэз.
Регуляторами эритропоэза наряду с гормонами являются витамины и микроэлементы. Микроэлементы (железо, медь, марганец и цинк) необходимы для: а) созревания эритробластов, дифференци-ровки их в нормоциты; б) синтеза гема и глобина (железо, кобальт, медь); в) стимуляции образования эритропоэтинов (кобальт); г) повышения обмена веществ в кроветворных органах, усиления насыщения эритроцитов гемоглобином (марганец). Однако чрезмерные концентрации марганца в организме затрудняют всасывание железа, приводят к развитию анемии. Недостаток- содержания меди в организме вызывает развитие микро-цитарной нормохромной анемии. Цинк, как известно, входит в состав различных гормонов (инсулина, половых гормонов, гормонов гипофиза), витаминов и в соответствии с этим также является одним из важнейших регуляторов эритропоэза.
Исключительно велика роль в регуляции эритропоэза фолиевой кислоты и витамина В12. Вещества, обладающие активностью фолиевой кислоты, широко распространены в природе; богатыми источниками их являются зеленые листья растений и дрожжи. Фолиевая кислота содержится также в печени, почках, мясе и других продуктах. Фолиевая кислота синтезируется микроорганизмами кишечника в количествах, достаточных для удовлетворения потребностей организма в этом витамине. Суточная потребность в свободной фолиевой кислоте для здорового человека составляет 1—2 мг. Фолиевая кислота стимулирует процессы биосинтеза ДНК в клетках костного мозга. При недостатке фолиевой кислоты формируется мегалобластический тип кроветворения,
характеризующийся нарушением дифферен-Шфовки и митотической активности эритро-идных клеток костного мозга, появлением мегалобластов, мегалоцитов в периферической крови.
Витамин В|2 — кобаламин, суточная потребность его составляет около 0,003 мг для взрослого человека. Основными источниками являются мясо, говяжья печень, почки, рыба, молоко, яйца. Усвоение витамина В|2, поступающего в организм с пищевыми продуктами, возможно лишь при взаимодействии его с внутренним фактором Кастла — га-стромукопротеидом, который продуцируется париетальными клетками слизистой оболочки желудка. При взаимодействии внешнего фактора (витамин B[2) с внутренним образуется термоустойчивый комплекс, в котором витамин В12 защищен от утилизации его микрофлорой кишечника. Основным местом депонирования витамина В!2 является печень. У человека и животных недостаток витамина Вц приводит к развитию макроцитарной, ме-галобластической анемии.
Что является сигналом индуцирующим синтез эритроцитов в костном мозге
Проведение профилактических осмотров и плановой госпитализации предоставило возможность фиксировать даже самые незначительные отклонения в лабораторных исследованиях, которые в большинстве случаев не сопровождаются клиническими проявлениями. Одним из таких показателей является определение уровня эритроцитов при исследовании периферической крови [1]. Снижение этих форменных элементов в основном является признаком анемического синдрома. Однако все чаще при проведении общего анализа крови определяется повышение их уровня, называемое эритроцитозом [2, 3]. Такое состояние является недооцененным результатом общего анализа крови. Литература, касающаяся определения его этиологии, в частности, с помощью анализа варианта гемоглобина, ограничена. Этот обзор направлен на обсуждение последних данных об этиологии эритроцитоза, механизмах его развития, а также пагубных последствиях.
Цель исследования: изучить особенности течения и причины эритроцитозов у детей.
Результаты исследования и их обсуждение
В связи с центральной ролью эритроцитов в доставке кислорода к тканям и утилизации углекислого газа в организме, контроль массы эритроцитов на точных уровнях имеет немаловажное клиническое значение как показатель индивидуальной реактивности и резистентности. Также, помимо транспорта газов, к функциям эритроцитов относят: адсорбирование и инактивацию токсинов, регуляцию рН крови (гемоглобиновый буфер), участие в свертывании крови и фибринолизе [4, 5]. Сам по себе эритроцитоз в основном не проявляется какими-либо симптомами, поэтому обнаруживается чаще именно при проведении планового профилактического обследования. Нормальное количество эритроцитов в капиллярной крови непостоянно на протяжении жизни и меняется по мере взросления ребенка. Так, в анализе пуповинной крови оно составляет 3,9*10¹² – 5,5*10¹² клеток/л. В возрасте от 1 до 3 дней – 4,0*10¹²–6,6*10¹² клеток/л. К 1 месяцу количество эритроцитов норме уменьшается до 3,0*10¹²–5,4*10¹² клеток/л. В 2 месяца уже 2,7*10¹²– 4,9*10¹² клеток/л. К полугодовалому возрасту норма эритроцитов составляет 3,1*10¹²– 4,5*10¹² клеток/л. Затем до 12 лет их количество остается относительно постоянным 3,5*10¹²–5,0*10¹² клеток/л. После полового созревания определяются половые различия в составе периферической крови: так у девочек нормальное количество эритроцитов должно составлять 3,5*10¹²–5,0*10¹² клеток/л, в то время как у мальчиков это 4,1*10¹²–5,5*10¹² клеток/л. Недостаточное снабжение кислородом вредно и может привести к гибели клеток, тканей или в конечном итоге даже организма [6, 7]. Чтобы избежать этого, развиваются сложные сердечно-сосудистые, дыхательные и гематологические механизмы. Организм, подвергаясь гипоксии, индуцирует активацию множества клеточных сигнальных путей, участвующих в регуляции метаболизма, обеспечивающего выживание клеток [7–9]. Однако низкий уровень кислорода не оказывает прямого воздействия на кроветворные клетки, но вызывает выработку гликопротеинового гормона эритропоэтина (Epo) почками, который сам по себе стимулирует эритропоэз [10, 11]. Эритропоэз является сложным многоэтапным процессом, в ходе которого предшественники эритроидов энуклеируются и трансформируются в зрелые эритроциты, и в основном осуществляется красным костным мозгом. Однако в ответ на стрессовые ситуации (к числу которых можно отнести анемические состояния, пересадку костного мозга и некоторые другие патологии) эритропоэз распространяется и осуществляется уже и в экстрамедуллярных участках [11–13]. В первую очередь внекостномозговые очаги кроветворения формируются в печени и селезенке, их активность ведет к повышению продукции эритроцитов. К примеру, печень может включаться в продукцию этого гормона после нефрэктомии и в условиях связанных с недостаточностью почек при их поражении и нарушении эндокринной функции почки [14, 15]. Следует также выделить пути альтернативной продукции эритропоэтина в таких компонентах, как моноциты крови и тканевые макрофаги [16]. Как было показано на мышах, стрессовый эритропоэз характеризуется массивным самообновлением клеток, форми- рующих взрывообразные единичные эритроидные клетки, и регулируется дополнительными внешними факторами, такими как гормон стресса кортизол, фактор стволовых клеток и костного морфогенетического белка [17]. У людей аналогичные пути еще не идентифицированы и молекулярная основа также недостаточно хорошо описана. Однако в последнее время сообщалось, что развитию эритробластических островных макрофагов и избыточному эритропоэзу способствует стресс [18]. Транскрипция Epo, в свою очередь, регулируется особым кислород-зависимым образом, с помощью фактора, индуцированного гипоксией (hypoxia inducible factor – HIF). Данный фактор присутствует практически в каждой клетке организма, организуя экспрессию каскада генов, которые позволяют акклиматизироваться к пониженному содержанию кислорода [19]. Среди белков этого семейства выделяют изоформы: HIF1, демонстрирующий повсеместный характер экспрессии и HIF2, обнаруживаемый в огра- ниченном числе типов клеток, включая эндотелиальные клетки, кардиомиоциты, гепатоциты, глиальные клетки и интерстициальные клетки почки. Соответственно особенностям локализации, предполагают, что HIF1 представляет собой ответ на острую гипоксию, тогда как HIF2 является преобладающей субъединицей к хроническому воздействию низкого содержания кислорода [19, 20]. Активность HIFα находится под контролем редкого механизма, основанного на стабильности структуры белка и его деградации, определяющейся содержанием кислорода. Сам по себе кислород не увеличивает концентрацию HIF, она более или менее стабильна. Кислород необходим для удаления HIF ферментами пролилгидро- ксилазного домена HIF, называемыми PHD. PHD гидроксилирует пролин – субъединицы фактора, индуцированного гипоксией, нацеливая последний на деградацию опухолевым супрессором белка фон Гиппеля – Линдау (VHL), тем самым подготавливая его для полиубиквитинирования, что в конечном итоге приводит к протеолитической деградации в убиквитин-протеасомном пути [19–21]. Этот процесс идет постоянно, окисляя и модифицируя HIF, клетка его все время «подъедает», малая концентрация не дает возможности добраться до ядра и активировать нужные гены. В условиях низкого содержания кислорода HIF стабилизируется почти мгновенно и транслоцируется в ядро, где он димеризуется с конститутивно экспрессируемой субъединицей HIF и способствует транскрипции генов [20, 21]. Редкие пациенты с эритроцитозом имеют мутации в генах, кодирующих PHD2, HIF-2 и VHL, что делает эти белки критически важными для правильного контроля массы эритроцитов у человека [21]. В 1997 г. Прчхал и его коллеги обнаружили первый тип эритроцитоза, связанный с HIF-путем. Они описали 103 человека из 81 семьи, живущих в Чувашской области в России, с эритроцитозом. Несколько пациентов были детально изучены и показали заметно повышенные уровни гематокрита, сопровождаемые значительно более высокими уровнями EPO. Последующие генетические исследования выявили гомозиготную мутацию в гене VHL (C598T, ведущую к замене аминокислоты R200W) у всех пораженных людей. Это привело к снижению сродства VHL к гидроксилированной субъединице HIFα, стабильной гиперпродукцией EPO, что клинически выражалось эритроцитозом [21, 22]. По этиологии все эритроцитозы подразделяют на первичные и вторичные. В свою очередь первичные классифицируют на приобретенную и наследственную форму. К группе первичных эритроцитозов относят наследственные (семейные) формы, которые обусловлены нарушениями экспрессии генов, клинически проявляющимися повышенной концентрацией эритроцитов и гемоглобина в периферической крови. Избыток эритроцитов определяет повышение вязкости крови, что сопровождается микроциркуляторными расстройствами: кровоточивостью, тромбозами, эмболиями, стазами, сладжами [22, 23]. Особенности течения первичных эритроцитозов обусловлены нарушениями скорости коагуляции и повышенной вязкостью крови, что клинически выражается проявлениями капиллярной кровоточивости и микроциркуляторными расстройствами, в частности в сосудах головного мозга (в редких случаях острого течения проявляется геморрагическим или ишемическим инсультом, при хроническом течении ведет к энцефалопатии, что в целом крайне неблагоприятно сказывается на когнитивном развитии ребенка) [23]. Симптоматика же достаточно неспецифична и проявляется в виде цефалгии, сниженной работоспособности, болезненности в нижних конечностях и в области сердца. При первичных эритроцитозах в общем анализе крови отмечается: эритроцитоз, смещение гематокрита в сторону форменных элементов и резкое замедление СОЭ [23, 24]. В разделе первичных приобретённых эритроцитозов отдельно стоит отметить эритремию (синонимы: истинная полицитемия, болезнь Вакеза). Данная патология относится к числу хронических лейкозов. Спорным остается вопрос об определении возможности наследственной предрасположенности к данному заболеванию, поскольку описаны случаи болезни сразу нескольких человек из одной семьи. В этиологии полицетемии вера, сходно с другими неоплазиями, выступают физические, химические и биологические онкогенные факторы. Воздействие онкогенов ведет к увеличению миелопролиферации в кроветворных органах. Это сопровождается усиленной активацией пролиферации эритроцитов, лейкоцитов и тромбоцитов, что клинически проявляется как полицитемия. У данной группы больных изменяется состав периферической крови в виде эритроцитоза, включая ретикулоцитоз, лейкоцитоза со сдвигом лейкоцитарной формулы влево, базофилии, моноцитоза и тромбоцитоза. В конечной стадии заболевания возникает гипоплазия костного мозга со значительным снижением костномозгового кроветворения, что приводит к возникновению панцитопении. При изучении отдельных исследований была отмечена отчетливая интенсификация продукции эритропоэтина как при разноэтиологических гипоксических состояниях, так и при поражении опухолевым процессом печени и почек, что, в свою очередь, может проявляться развитием симптоматического эритроцитоза. По патогенезу эритроцитозы могут быть как абсолютными, так и относительными. Так, абсолютные эритроцитозы проявляются в виде увеличенного содержания красных кровяных телец в периферической крови, что связано с активацией эритропоэза в красном костном мозге, про- воцируемое влиянием стимулирующих воздействий гормонального и гуморального генеза. Относительные эритроцитозы отмечаются при нормальной активности эритро- поэза, в основе их развития лежит сладж-феномен, характеризующийся сгущением крови [24]. Классификация вторичных абсолютных эритроцитозов основывается на их значимости и патогенетических механизмах развития. Вторичные абсолютные эритроцитозы могут быть гипоксемическими, или компенсаторными, и негипоксемическими. Эритроцитоз при гипоксических состояниях является адаптационной реакцией организма под воздействием патогенного фактора, поэтому его альтернативное название – компенсаторный. К компенсаторным причинам развития эритроцитоза у детей можно отнести следующие:
1. Повышенная физическая нагрузка. Во время повышенных физических нагрузок сердечно-сосудистая система должна обеспечивать поступление субстрата в работающую мышцу. Основной функцией эритроцитов при мышечной работе является транспортировка О2 из легких в ткани и доставка метаболически продуцируемого CО2 в легкие для выдоха. Гемоглобин также способствует буферной способности крови, а высвобождение АТФ и NO из эритроцитов способствует вазодилатации и улучшает приток крови к работающей мышце. Эти функции требуют адекватного количества эритроцитов в кровообращении. Это объясняет повышение уровня эритропоэза как компенсаторной функции для потребления большего количества О2.
2. Недостаточное потребление или потеря жидкости. Под действием недостаточного содержания воды в эритроците он претерпевает морфологические изменения. Это провоцирует эритропоэз, что приводит к повышению их уровня в периферической крови.
3. Заболевания дыхательной системы. Хроническое заболевание легких может вызвать хроническую гипоксемию и привести к повышению эритроцитов в крови. Значительно ухудшить вентиляцию легких и тем самым вызвать эритроцитоз может также ожирение тяжелой степени (синдром Пиквика). В таких условиях гемоглобин не может быть достаточно насыщен О2, что приводит к возникновению гипоксии в тканях.
4. Заболевания сердечно-сосудистой системы. Постоянное увеличение эритроцитов при сердечно-сосудистых заболеваниях объясняется эффективной стимуляцией эритропоэза эритропоэтином, гормоном, секретируемым во время гипоксических явлений.
5. Местность проживания. Еще в 19 в. ученые обнаружили корреляцию между низким атмосферным давлением кислорода и повышенным количеством эритроцитов у людей и животных. Атмосферное давление на уровне моря обеспечивает кислороду легкое прохождение через избирательно проницаемые легочные мембраны в кровь. На больших высотах более низкое давление воздуха затрудняет проникновение кислорода в систему крови. Результатом чего является гипоксия, провоцируя эритропоэз.
6. Пассивное курение. Дети, проживающие в семьях курильщиков, постоянно подвергаются пассивному воздействию табачного дыма, что вызывает гипоксические состояния и стимулирует эритропоэз, что клинически может проявляться эритроцитозом.
7. Ожирение. Считается, что при ожирении чрезмерное отложение липидов ведет к гипертрофии адипоцитов, приводя к гипоксии в белой и бурой жировой ткани. Гипоксия в них стимулирует повышенное выделение адипоцит-специфического фактора индуцированного гипоксией HIF2α, что вначале обеспечивает компенсацию, но, характеризуясь эффектами инсулинорезистентности, усиливает ожирение, вызванное ожирением, формируя порочный круг и нарушая метаболическую регуляцию.
Под абсолютным негипоксемическим эритроцитозом следует понимать состояние, не являющееся компенсаторно-приспособительным механизмом, так как обусловлено повышенным синтезом эритропоэтина поврежденными почками. Данное состояние развивается в случае таких патологий, как опухолевые поражения, поликистоз, также может наблюдаться вследствие стеноза почечных артерий, гидронефроза, нефрэктомии и пересадки почки. К числу этиологических факторов, вызывающих вторичные негипоксемические эритроцитозы, относят онкологические заболевания печени, селезенки, сопровождает течение синдрома Иценко – Кушинга, по причине нарастающего стабильно высокого выделения гормонов АКТГ и глюкокортикоидов. Клинические проявления вторичных абсолютных эритроцитозов разнообразны, в значительной мере обусловлены особенностями этиологических факторов и основного заболевания. Тем не менее общими признаками эритроцитозов являются умеренная полицитемическая гиперволемия, увеличение вязкости крови и гематокрита, повышение артериального давления, развитие гипертрофии миокарда, расстройства микроциркуляции, наличие микротромбоза. В периферической крови отмечаются эритроцитоз, ретикулоцитоз, отсутствуют тромбоцитоз и лейкоцитоз [24, 25].
Заключение
Растущие знания о генетических и физиологических изменениях в организме ребенка при эритроцитозах требуют фундаментальных изменений в рекомендациях по диагностическому подходу и ведению детей с эритроцитозом. Анализ литературных данных позволяет отметить, что наличие знаний о референтных значениях эритроцитов у детей и подростков чрезвычайно важно для правильной интерпретации результатов полного анализа крови. Повышение количества эритроцитов крови не всегда свидетельствует о наличии патологии, связанной с избыточной их продукцией в красном костном мозге. Путь фактора HIF играет центральную роль в развитии реакции на гипоксию, поскольку он регулирует экспрессию генов, реагирующих на гипоксию. В условиях гипоксии эта посттрансляционная модификация HIF ингибируется, что стабилизирует ее, и увеличение экспрессии РНК-мессенджера HIF-1 способствует транскрипционной активации генов, в том числе и для ЭПО. Соответственно, достаточный уровень кислорода, не дает проявиться транскрипционной активности. Мутации в белках пути HIF могут приводить к эритроцитозу у человека.
