эритроидный росток костного мозга сужен
Апластическая анемия
Апластическая анемия является тяжелым заболеванием крови, при котором развивается угнетение всех ростков костного мозга. Причины заболевания различные – от генетической предрасположенности до вредоносного действия ионизирующего излучения и различных химических соединений. Клинически заболевание проявляется анемическим, тромбоцитопеническим синдромом, а также выраженными инфекционными осложнениями.
Диагноз выставляется исходя из клинической картины, анализов крови и пункции костного мозга.
Что такое апластическая анемия?
Апластическая анемия является патологическим состоянием организма, при котором снижается количество всех трех типов клеток крови (эритроцитов, лейкоцитов и тромбоцитов) вследствие замедления или полного прекращения образования их в костном мозге.
По происхождению апластические анемии делятся на:
В большинстве случаев наблюдается угнетение всех трех ростков кроветворения, однако клинически замечено, что в различные фазы болезни может наблюдаться более выраженное угнетение какого-то одного из ростков
По преимущественному поражению костномозговых ростков выделяют:
Причины апластической анемии
Причины апластической анемии различаются при врожденной и приобретенной анемии.
Различают следующие причины приобретенных апластических анемий:
Некоторые вредоносные агенты непосредственно воздействуют на костный мозг (ионизирующее излучение, химические и лекарственные вещества). Иные воздействуют опосредованно через аутоиммунные механизмы (вирусный гепатит В).
Диагностика апластической анемии
Клиническая картина заболевания может в значительной степени ориентировать врача в направлении анемии, однако диагноз должен быть подтвержден или опровергнут при помощи лабораторных анализов и параклинических исследований.
Наиболее ценными дополнительными исследованиями являются:
Общий анализ крови
Данные общего анализа крови при апластической анемии свидетельствуют в пользу панцитопении (снижение количества всех трех типов клеток костного мозга). Уменьшение количества лейкоцитов наблюдается преимущественно за счет снижения гранулоцитов (нейтрофилы, эозинофилы и базофилы). Таким образом, относительно увеличивается процент лимфоцитов и моноцитов в лейкоцитарной формуле. На различных стадиях заболевания могут быть выявлены воспалительные признаки в той или иной мере.
Ориентировочными показателями ОАК при апластической анемии являются:
Гемоглобин (Hb) – менее 110 г\л (норма 120 – 160 г\л). Уменьшение за счет снижения числа эритроцитов.
Эритроциты – 0,7 – 2,5 х 1012\л (норма 3,7 х 1012\л). Снижение количества зрелых эритроцитов.
Цветовой показатель – 0,85 – 1,05 (норма 0,85 – 1,05) свидетельствует о нормохромном характере анемии (содержание гемоглобина в эритроците в пределах нормы).
Гематокрит (Ht) – менее 30 (норма 35 – 42 у женщин и 40 – 46 у мужчин). Соотношение клеточного состава крови к ее жидкой части. Наблюдается явное уменьшение доли клеток в периферической крови.
Тромбоциты – менее 35 промилле или 100 х 109\л. Снижение количества тромбоцитов.
Лейкоциты – 0,5 – 2,5 х 109\л (норма 4 – 9 х 109\л). Выраженная лейкопения за счет снижения числа гранулоцитов (нейтрофилы, эозинофилы и базофилы).
Палочкоядерные нейтрофилы – 0 – 2% (норма менее 6%). Снижение выработки молодых форм лейкоцитов.
Сегментоядерные нейтрофилы – 0 – 40% (норма 47 – 72%). Снижение количества зрелых форм нейтрофилов.
Миелоциты – 0 – 2% (в норме отсутствуют). В условиях гранулоцитопении и наслоения бактериальной инфекции наблюдается более выраженный, чем обычно, сдвиг лейкоцитарной формулы влево с появлением клеток предшественников лейкопоэза.
Эозинофилы – 0 – 1% (норма 1 – 5%). Снижение количества эозинофилов.
Базофилы – 0% (норма 0 – 1%). Единичные или полное отсутствие базофилов.
Лимфоциты – более 40% (норма 19 – 37%). Численное количество лимфоцитов остается в норме. За счет снижения фракции гранулоцитов наблюдается относительный лимфоцитоз (увеличение доли лимфоцитов в крови). Крайне выраженный лимфоцитоз может наблюдаться при наслоении вирусных инфекций.
Моноциты – более 8% (норма 6 – 8%). Количество моноцитов неизменно и находится в пределах нормы. Моноцитоз (увеличение доли моноцитов в крови) объясняется снижением процентной доли гранулоцитов в лейкоцитарной формуле.
Скорость оседания эритроцитов – более 15 – 20 мм\час (норма до 10 мм/час у мужчин и до 15 мм/час у женщин). Данный показатель отражает степень выраженности воспалительной реакции в организме.
Анизоцитоз – наличие в крови эритроцитов различного размера.
Пойкилоцитоз – наличие в крови эритроцитов различной формы.
Биохимический анализ крови
Некоторые виды биохимических анализов крови могут акцентировать внимание врача на отклонениях в организме, которые косвенно вписываются в три вышеперечисленных анемических синдрома.
Ориентировочными показателями БАК при апластической анемии являются:
Сывороточное железо более 30 мкмоль\л (норма 9 – 30 мкмоль/л). Увеличение сывороточного железа на фоне частых переливаний крови. Высокий риск развития гемохроматоза.
Эритропоэтин более 30 МЕ\л (норма 8 – 30 МЕ/л у женщин и 9 – 28 МЕ\л у мужчин). Увеличение эритропоэтина происходит по двум причинам. Во-первых, не происходит его потребления клетками эритроцитарного ростка. Во-вторых, компенсаторно усиливается его синтез в ответ на анемию.
С-реактивный белок – более 10 – 15 мг\л (норма 0 – 5 мг\л). Выявляется при воспалительной реакции на фоне ослабленного иммунитета.
Стернальная пункция
Данный вид исследования используется с целью визуализации клеток костного мозга и их процентного соотношения.
При апластической анемии миелограмма будет скудной, количество клеточных элементов значительно снижено. Камбиальные клетки эритроцитарного и лейкоцитарного ряда единичны или отсутствуют. Мегакариобласты отсутствуют. В редких случаях при пункции случается встретить сгруппированные очаги повышенной пролиферации клеток как компенсаторную реакцию здорового костного мозга на анемию. Такая миелограмма может сбить с толку, поскольку будет свидетельствовать в пользу отсутствия апластической анемии и поэтому будет ложноотрицательной.
Трепанобиопсия
Трепанобиопсия является способом изъятия части костного мозга из крыла подвздошной кости пациента. Преимущество данной процедуры над стернальной пункцией заключается в возможности забора большего количества материала с сохранением его структуры. Большее количество материала уменьшает вероятность ложноотрицательного результата апластической анемии, а изучение структуры костного мозга позволяет помимо цитологического исследования (миелограммы) провести еще и гистологическое.
При помощи анализа крови и результатов трепанобиопсии возможно определение степени тяжести апластической анемии.
гранулоциты менее 2,0 х 109\л;
тромбоциты менее 100 х 109\л;
ретикулоциты менее 2 – 3%;
гипоплазия костного мозга на трепанобиопсии.
гранулоциты менее 0,5 х 109\л;
тромбоциты менее 20 х 109\л;
ретикулоциты менее 1%;
аплазия костного мозга на трепанобиопсии.
гранулоциты менее 0,2 х 109\л;
тромбоциты единичные или отсутствуют;
ретикулоциты единичные или отсутствуют;
аплазия костного мозга на трепанобиопсии.
Прогноз при апластической анемии
Прогноз при апластической анемии во многом зависит от сроков обнаружения заболевания. При раннем обнаружении существует возможность более активного вмешательства в течение заболевания. При более позднем обнаружении шансы на излечение уменьшаются.
Врожденная апластическая анемия Фанкони в большинстве случаев крайне тяжело поддается лечению, поскольку костный мозг никогда не был здоровым и, соответственно, очень сложно восстанавливается. Наличие врожденных аномалий развития сильно ограничивает показания к пересадке костного мозга таким пациентам. В большинстве случаев больные погибают в детском возрасте от аномалий развития или инфекционных осложнений.
Приобретенные апластические анемии имеют более благоприятный прогноз, поскольку в некоторых случаях являются обратимыми после прекращения действия повреждающего фактора на костный мозг.
Врач лабораторной диагностики
Новополоцкой городской больницы
Костюк К.С.
Приемная главного врача
(+375 214) 50-62-70
(+375 214) 50-62-11 (факс)
Канцелярия
(+375 214) 50-15-39 (факс)
Миелограмма
Фиксированные и окрашенные препараты костного мозга исследуют сначала под малым увеличением. При этом оценивают:
В результат подсчета миелограммы должны входить следующие виды клеток:
Отдельно на бумаге подсчитывают количество митозов. Выражают их на 100 клеток в каждом ряду.
Костно-мозговые индексы.
Клеточный состав костного мозга подвержен значительным количественным и качественным колебаниям, поэтому для объективной оценки пунктата костного мозга помимо подсчета миелограммы необходимо определение соответствующих костно-мозговых индексов.
Лейко-эритробластическое отношение
Следует отметить, что при гипоплазии и аплазии костного мозга, когда снижено количество клеток и лейкопоэза, и эритропоэза, лейко-эритробластическое отношение может быть в пределах нормы.
Индекс созревания нейтрофилов
Индекс созревания нейтрофилов (ИСН) выражает отношение молодых нейтрофильных гранулоцитов к зрелым и вычисляется по формуле:
(промиелоциты + миелоциты + метамиелоциты) / (палочкоядерные нейтрофилы + сегментоядерные нейтрофилы).
Снижение индекса созревания нейтрофилов может быть обусловлено значительной примесью периферической крови.
Индекс созревания эритрокариоцитов
(полихроматофильные + оксифильные нормобласты) / (эритробласты + пронормобласты + все нормобласты).
Снижение индекса созревания эритрокариоцитов наблюдается при железодефицитной и свинцовой анемиях, талассемии, гемоглобинопатиях и др. состояниях (когда идет нарушение синтеза гемоглобина).
Результаты исследования костного мозга оформляются в виде бланка. В зависимости от требований, предъявляемых лаборатории клиницистами, от «местных» лабораторных условий форма бланка и последовательность его заполнения может значительно варьировать в разных лабораториях, но обычно бланк состоит из двух частей: цифровой и описательной. Результаты подсчета миелограммы составляют цифровую часть бланка. Здесь помимо результатов исследования должны быть приведены нормальные величины всех показателей.
Клеточный состав костного мозга
Под цифровой частью бланка следует описательная часть с выводами. Прежде чем сделать окончательное заключение о состоянии костного мозга, необходимо соотнести полученные данные с нормой и с результатами исследования периферической крови. В ряде случаев необходимо решить, не разведен ли костный мозг кровью, так как по препарату, сильно разведенному периферической кровью, невозможно достоверно оценить костно-мозговое кроветворение. В таких случаях рекомендуется повторная пункция.
Признаки разведения костного мозга периферической кровью:
В описательной части обращают внимание на следующие моменты:
Затем необходимо охарактеризовать ростки кроветворения:
миелоидный росток:
эритроидный росток:
мегакариоцитарный росток:
При повышении содержания плазматических клеток в мазках следует указать
Описать нехарактерные для костного мозга клетки (в случае их присутствия):
При обнаружении в костно-мозговом пунктате неидентифицируемого вида клеток необходимо описать их по следующим признакам:
В конце описательной части, если позволяют данные, ставится предполагаемый лабораторный диагноз. Мазки костного мозга маркируют и хранят в архиве.
Литература:
Похожие статьи
Морфологическое исследование клеток костного мозга
Морфологическое исследование клеток костного мозга проводится в окрашенном препарате. Приготовление, фиксация и окраска мазков костного мозга осуществляются также, как и мазков периферической крови.
Раздел: Гемоцитология
Морфология клеток мегакариоцитарного ростка
Раздел: Гемоцитология
Морфология клеток ретикулярной стромы
Ретикулярные клетки довольно большого размера (18-30 мкм). Ядро круглое или овальное, структура ядра ажурная, иногда неравномерно-нитчатая и напоминает ядро моноцита, может содержать 1-2 ядрышка. Цитоплазма обильная, чаще всего с нерезко очерченными границами, нередко отростчатая, окрашивается в светло-голубой или серовато-голубой цвет, иногда содержит пылевидную азурофильную зернистость. В норме эти клетки в пунктате костного мозга содержатся в небольшом количестве.
Раздел: Гемоцитология
Подсчет миелокариоцитов
Раздел: Гемоцитология
Морфология клеток моноцитарного ростка
Раздел: Гемоцитология
Диагностика и лечение хронической аутоиммунной гемолитической анемии
Больная Ш., 80 лет, пенсионерка. Из анамнеза известно, что в течение последних двух лет неоднократно проходила амбулаторное и стационарное лечение по поводу хронической B12–фолиеводефицитной анемии, диагностированной на основании анемического синдрома в сочетании с гиперхромией и макроцитозом эритроцитов. Стернальная пункция, определение уровня витамина B12 и фолиевой кислоты не проводились. Отмечался временный незначительный положительный эффект лечения витамином B12. С конца 2011 года, несмотря на ежемесячное введение витамина B12 в дозе 500γ в сочетании с фолиевой кислотой, стала нарастать анемия (14.02.2012 г. гемоглобин – 54 г/л). Для обследования и лечения госпитализирована в больницу № 40 с диагнозом: B12–фолиеводефицитная анемия тяжелой степени. ИБС. Стенокардия напряжения II ф. к. Гипертоническая болезнь II ст. Желчнокаменная болезнь. Хронический калькулезный холецистит. Мочекаменная болезнь. Конкремент правой почки, простые кисты обеих почек. Полипы желудка.
При поступлении жалобы на выраженную общую слабость, головокружения, головную боль, учащенное сердцебиение, перебои в работе сердца.
При объективном осмотре отмечены субиктеричность кожи и слизистых оболочек, умеренная гепатомегалия (+2 см) и спленомегалия (+ 2 см).
Результаты клинического анализа в динамике представлены в таблице 1.
Таблица 1. Клинические анализы крови пациентки Ш. в динамике
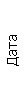 | 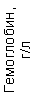 | 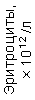 | 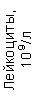 | 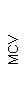 | 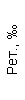 |  | 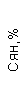 | 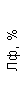 | 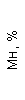 | 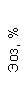 | 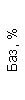 | 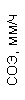 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 15.02.12 | 54 | 1.39 | 10.5 | 133 | 80 | 2 | 66 | 21 | 9 | 2 | — | 75 |
| 11.03.12 | 50 | 1.41 | 11.8 | 114 | 98 | 4 | 75 | 11 | 4 | 3 | 1 | 78 |
| 15.03.12 | 49 | 1.31 | 17.8 | 121 | 288 | 4* | 60 | 23 | 5 | 1 | — | 78 |
| 20.03.12 | 72 | 1.93 | 11.4 | 116 | 297 | 2 | 73 | 14 | 7 | 2 | 0 | 46 |
| 27.03.12 | 66 | 1.9 | 11 | 108 | 202 | 2 | 60 | 26 | 7 | 3 | 0 | 40 |
| 12.04.12 | 70 | 1.75 | 1.9 | 112 | 104 | 3 | 62 | 24 | 11 | 0 | 0 | 27 |
| 26.04.12 | 93 | 2.56 | 5.7 | 109 | 148 | 3 | 74 | 13 | 9 | 0 | 0 | 11 |
| 24.06.12 | 111 | 3.42 | 4.7 | 97 | 7 | 2 | 69 | 21 | 10 | 0 | 1 | 15 |
| 16.08.12 | 120 | 3.97 | 5.8 | 93 | 12 | — | 71 | 19 | 9 | 1 | 0 | 40 |
Примечание: * в лейкоцитарной формуле 15.03.12 выявлялись также миелоциты (2%) и метамиелоциты (5%).
В биохимическом анализе крови – повышение уровня креатинина (189 ммоль/л), билирубина (58 ммоль/л) за счет непрямого билирубина.
УЗИ органов брюшной полости: гепатоспленомегалия; камни желчного пузыря; диффузные изменения поджелудочной железы; простые кисты обеих почек, конкремент правой почки.
ФГДС: два полипа желудка размером до 0,5 см.
Учитывая высокий риск сердечно-сосудистых осложнений у пожилой пациентки с анемией тяжелой степени, проведены трансфузии эритроцитарной взвеси. На основании клинико-лабораторных данных (спленомегалия, гипербилирубинемия, гиперхромная анемия с ретикулоцитозом) и неэффективности лечения витамином B12 и фолиевой кислотой заподозрена гемолитическая анемия.
При исследовании крови на антиэритроцитарные антитела выявлены аутоантитела класса IgG ++++.
Результаты стернальной пункции представлены в таблице 2.
Таблица 2.Миелограмма пациентки Ш. от 17.02.12 г.
Заключение
Клеточный костномозговой пунктат. Эритропоэз – нормобластический. Гиперплазия эритроидного ростка – 74,8%. Со стороны эритрокариоцитов отмечаются клетки с цитоплазматическими мостиками, скопления в виде «эритроидных островков».
Мегакариоциты различной степени зрелости с умеренным тромбоцитообразованием.
На основании данных миелограммы (гиперплазия эритроидного ростка при нормобластическом типе кроветворения) и выявления антиэритроцитарных антител диагностирована аутоимунная гемолитическая анемия с тепловыми антителами. При дополнительном обследовании признаков вторичного характера анемии не выявлено.
С 11.03.12 г. начата пульс-терапия метипреднизолоном в дозе 500 мг 1 раз в день внутривенно в сочетании с пероральным приемом преднизолона в дозе 45 мг в сутки под прикрытием гастропротекторов. После 5 дней лечения анемический синдром продолжал нарастать, появился выраженный сдвиг лейкоцитарной формулы влево, увеличение количества ретикулоцитов (табл.1). Доза преднизолона перорально увеличена до 75 мг в сутки, к лечению добавлен азатиоприн по 100 мг/сутки per os, проведена трансфузия1 дозы эритроцитарной взвеси.
С 20.03.12 г. с учетом сохраняющегося гемолиза (ретикулоциты 297‰) проведен второй курс пульс-терапии метилпреднизолоном в дозе 500 мг в сутки № 4, однократно введен внутривенно циклофосфан в дозе 600 мг.
Лечение больная переносила хорошо. С 27.03.12 г. отмечена тенденция к увеличению уровня гемоглобина без поддерживающих гемотрансфузий. Решено продолжить введение циклофосфана по 200 мг в сутки, отменить азатиоприн. Анемический синдром продолжал уменьшаться: к 12.04.12 г. уровень гемоглобина достиг 70 г/л, снизился гемолиз (ретикулоцитов 104‰), однако развилась лейкопения (1,9×10 9 /л), в связи с чем циклофосфан был временно отменен. После восстановления количества лейкоцитов лечение циклофосфаном по 200 мг дважды в неделю было возобновлено на фоне постепенного снижения дозы преднизолона.
Больная в удовлетворительном состоянии 28.04.12 г. выписана из стационара. На амбулаторном этапе продолжено введение циклофосфана по 200 мг в сутки 2 раза в неделю, преднизолон в течение месяца полностью отменен.
В течение нескольких месяцев получала поддерживающую терапию циклофосфаном по 200 мг в сутки 2 раза в неделю (суммарная доза составила 7200 мг). На этом фоне уровень гемоглобина стабилен в пределах 100–120 г/л, количество ретикулоцитов не превышает 20%.
Комментарий к клиническому случаю
Аутоиммунная гемолитическая анемия (АИГА) – гетерогенная группа заболеваний и синдромов, обусловленных повышенным разрушением эритроцитов вследствие образования аутоантител. Частота АИГА во всех возрастных группах составляет 1:40000 – 1:80000, причем женщины болеют в 2 раза чаще мужчин. Выделяют первичные (идиопатические) и вторичные АИГА, которые чаще всего развиваются при лимфомах, солидных опухолях и заболеваниях соединительной ткани. По серологическим свойствам различают АИГА с тепловыми (85%) и холодовыми (15%) антителами; по месту разрушения эритроцитов выделяют АИГА с внутриклеточным (наиболее частым), внутрисосудистым и смешанным гемолизом.
Клинические проявления АИГА:
При внутрисосудистом гемолизе моча приобретает темно-бурую или черную окраску.
Лабораторные критерии:
Стандарт первой линии терапии АИГА – пероральные глюкокортикостероиды в начальной дозе 1 мг/кг в сутки, возможно проведение пульс-терапии метилпреднизолоном в дозе 0,5–1,0 г/сутки внутривенно в течение 3-5 дней. Второй линией терапии является спленэктомия, которая используется при отсутствии эффекта глюкокортикостероидов в течение 4–6 месяцев. У пожилых пациентов показано назначение иммунодепрессивных и цитостатических препаратов (азатипоприн, циклофосфон, циклоспорин). Значительно реже используют моноклональные антитела (ритуксимаб) и иммуноглобулин. Выживаемость больных АИГА в течение 5 лет составляет 75%.
При анализе данного случая обращает внимание длительное латентное течение заболевания у больной преклонного возраста с гиперхромной анемией, что послужило причиной ошибочного диагноза B12–дефицитной анемии (для АИГА характерен нормохромный характер анемии). С учетом возраста пациентки и наличия сопутствующих заболеваний было принято решение о подключении к лечению цитостатической терапии, позволившее получить ремиссию заболевания, отменить глюкокортикостероиды и отказаться от проведения спленэктомии.
Миелодиспластический синдром у взрослых
Общая информация
Краткое описание
Приложение 5
к приказу
Министерства здравоохранения
Республики Беларусь
КЛИНИЧЕСКИМ ПРОТОКОЛ
диагностики и лечения пациентов в возрасте старше 18 лет
с миелодиспластическим синдромом
1. Клинический протокол диагностики и лечения пациентов с заболеванием «миелодиспластический синдром» (далее-МДС) предназначен для оказания медицинской помощи в амбулаторных и стационарных условиях районных, областных и республиканских организаций здравоохранения, имеющих в своем составе гематологические отделения.
2. Возрастная категория: взрослое население.
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
Классификация
КЛАССИФИКАЦИЯ ЗАБОЛЕВАНИЯ
5. Классификация МДС, принятая Всемирной организацией здравоохранения (далее-ВОЗ) в 2008 году базируется на цитоморфологических, кариотипических и клинических признаках заболевания.
Классификация миелодиспластических синдромов
сбалансированные аномалии: t(l 1; 16)(q23;p 13.3); t(3;21) (q26.2;q22.1); t(l;3) (рЗб.З; q21.1); t(2;l 1) (p21;q23); inv(3) (q21q26.2); t(6;9)(p23;q34);
сложный кариотип (3 или более хрмосомных аномалий) с вовлечением вышеупомянутых нарушений.
Диагностика
КРИТЕРИИ ДИАГНОЗА МДС
8. Вспомогательные критерии (С) (для пациентов, имеющих критерии А, но не имеющих критерии В).
8.1. Аномальный иммунный фенотип эритроидных или миелоидных клеток костного мозга, указывающий на их клональное происхождение (по результатам проточной цитометрии).
8.2. Молекулярно-генетические признаки наличия клональной клеточной популяции в костном мозге (по результатам HUMARA исследования или биологического микрочипирования).
8.3. Значительное и стабильное снижение колониеобразующей активности костного мозга и/или периферической крови.
Диагноз устанавливается при наличии 2 предварительных критериев (А) и не менее чем одного МДС-ассоциированных критериев (В). Вспомогательные
критерии (С) используются при отсутствии критериев В и наличии у пациента признаков клональной миелоидной пролиферации. Критерии группы С не входят в обязательный стандарт диагностики МДС.
Диагноз «идиопатическая цитопения неопределенного значения» применяется для обозначения случаев цитопении по одной и более клеточным линиям в течение > 6 месяцев при отсутствии критериев МДС и других причин цитопении. Такие пациенты должны наблюдаться и обследоваться гематологом с интервалом 1-6 месяцев.
Диагностические критерии разработаны ICWG (International Consensus Working Group), 2007 г.
Алгоритм диагностики МДС включает в себя клинические и лабораторные исследования, мультидисциплинарный подход с привлечением смежных специалистов и последовательно проводится на базе учреждений здравоохранения различного уровня с соблюдением преемственности на всех этапах. Это обусловлено полиэтиологичностью и гетерогенностью проявлений при данной патологии, стремлением к рационализации использования специального диагностического оборудования, минимизации диагностических ошибок.
Этапы диагностики МДС:
Лечение
КЛИНИЧЕСКИЕ ВАРИАНТЫ МДС
10. Определение клинического варианта МДС имеет значение для выбора тактики лечения.
10.1. 5ц-синдром: болеют преимущественно женщины, характерны вялотекущий характер заболевания, низкая вероятность трансформации в ОМЛ (10%), тяжелая макроцитарная анемия, нормальный или умерено сниженный уровень лейкоцитов и тромбоцитов, дисплазия мегакариоци- тарного ростка, отсутствие значительно повышения уровня бластных клеток в костном мозге; хороший ответ на леналидомид*.
10.2. Вторичный МДС: частота вторичного МДС нарастает в связи с успехами химиотерапии опухолей и воздействием загрязнения окружающей среды; для большинства пациентов характерны множественные хромосомные аберрации; прогноз хуже, чем при первичном МДС.
10.3. Гипопластический МДС:
до 15% случаев МДС характеризуются низкой клеточностью костного мозга при гистологическом исследовании (доля кроветворной ткани в препарате менее 30% у пациентов моложе 60 лет или менее 20% у пациентов 60 лет и старше);
дисплазия мегакариоцитов и клеток миелоидного ряда может отсутствовать;
возможны трудности в дифференциации от апластической анемии, для которой характерна более выраженная панцитопения, отсутствие типичных для МДС хромосомных аббераций и снижение содержания CD34+ клеток в костном мозге.
10.4. МДС с миелофиброзом: до 50% случаев всех вариантов МДС характеризуется фиброзом костного мозга (до 15% имеют выраженный фиброз); фиброз более характерен для вторичного МДС; характерны ги- перклеточность костного мозга, диффузный ретикулиновый фиброз его стромы и дисплазия не менее чем в 2 клеточных линиях; в периферической крови панцитопения, признаки клеточной дисплазии и лейкоэрит- робластоза; органомегалия нехарактерна; заболевание быстро прогрессирует; необходимо дифференцировать от острого мегакариобластного лейкоза, острого миелофиброза (острого панмиелоза с фиброзом), хронических миелопролиферативных заболеваний, метастатического рака, лимфом и волосатоклеточного лейкоза.
ЛЕЧЕНИЕ
11. Выбор терапии основан на диагнозе и группе риска по международной прогностической бальной системе (IPSS). В соответствии с международными рекомендациями для выбора терапевтической тактики пациентов с МДС подразделяют на 2 большие группы риска:
группу относительно низкого риска, включая в нее пациентов с низким и промежуточным 1 риском по системе IPSS;
группу высокого риска, включая в нее пациентов с промежуточным 2 и высоким риском по системе IPSS.
У пациентов из группы относительно низкого риска возможно применение только поддерживающей терапии либо терапии малой интенсивности. Интенсивная терапия показана пациентам группы высокого риска с учетом возраста, анамнеза заболевания, клинических проявлений, общего состояния и наличия признаков прогрессирования заболевания.
11.1. Поддерживающее лечение.
Поддерживающее лечение назначают с целью уменьшения проявлений заболевания и поддержания качества жизни. У пациентов из группы относительно низкого риска это может быть основным видом терапии.
11.1.1. Трансфузии донорских эритроцитов. Основным клиническим показанием для трансфузии донорских эритроцитов является не столько уровень гемоглобина, сколько степень адаптированности пациента к анемии.
11.1.2. Применение хелаторов железа.
Показаниями к применению хелаторов железа является переливание более 20-25 доз эритроцитной массы, уровень сывороточного ферритина более 2500 мкг/л, наличие дисфункции сердца (аритмия, сердечная недостаточность) и поражения печени.
Дефероксамин применяют в дозе 30-40 мг/кг в виде 12 часовых подкожных инфузий 5-7 раз в неделю (ночью). Дозу лекарственного средства снижают до 25 мг/кг при уровне ферритина ПО г/л, тромбоциты > 100 • 10 9 /л, нейтрофилы >1,0-10 9 /л, нет бластных клеток
время ремиссии, уменьшение абсолютного числа гранулоцитов, тромбоцитов, снижение концентрации НЬ на > 15 г/л или появление трансфузионной зависимости
Частичный: сокращение количества клеток, имеющих хромосомные аномалии на > 50 %
Гранулоциты (начальное количество 9 /л): прирост на 100 % и абсолютное количество > 0,5 • 10 9 /л
Прогноз
Для оценки прогноза и определения тактики лечения пациентов с МДС используют международную прогностическую бальную систему (далее IPSS).

